Симультанная проба на туберкулез у животных
Г.И.Устинова, к.б.н., ведущий научный сотрудник лаборатории биохимии и молекулярной биологии
Н.Г.Толстенко, к.в.н., ведущий научный сотрудник лаборатории микобактериозов
Е.П.Вангели, к.б.н., ведущий научный сотрудник лаборатории микобактериозов
О.Д.Кучерук, к.в.н., старший научный сотрудник лаборатории биохимии и молекулярной биологии
В.М.Калмыков, к.в.н., старший научный сотрудник лаборатории микобактериозов
Всероссийского научно-исследовательского института экспериментальной ветеринарии имени К.И.Скрябина и Я.Р.Коваленко РАН, 109428, Москва, Рязанский пр-т, 24, к. 1, admin@viev.ru.
Представлено современное состояние диагностики туберкулеза у крупного рогатого скота. Указаны основные достоинства и недостатки аллергической диагностики, а также пути совершенствования дифференциальной диагностики неспецифических реакций в благополучных по туберкулезу хозяйствах.
На современном этапе борьбы с туберкулезом животных основой профилактических и оздоровительных мероприятий является диагностика болезни, а основным методом прижизненной диагностики – аллергический метод с применением внутрикожной пробы с ППД-туберкулином для млекопитающих.
Недостаток внутрикожной пробы в том, что аллергическая реакция на ее применение указывает только на сенсибилизацию организма животных различными видами микобактерий. А в связи с тем, что особи могут быть заражены не только микобактериями туберкулеза, но и разного вида близкородственными нетуберкулезными микобактериями, проба выявляет наряду с больными и здоровых животных с неспецифическими реакциями на туберкулин [5,6].
В итоге проявление неспецифических реакций делает внутрикожную пробу ориентировочной и вызывает необходимость применения патологоанатомических и лабораторных исследований с целью подтверждения диагноза на туберкулез.
В соответствии с санитарными и ветеринарными правилами от 1996 г. и наставлением по диагностике туберкулеза животных от 2002 г., в нашей стране контроль по данному заболеванию у крупного рогатого скота проводят внутрикожной пробой с ППД для млекопитающих два раза в год (весной и осенью). Реагирующими считают животных с увеличением толщины кожной складки на 3 мм и выше. Причем реагирующие животные считаются подозреваемыми в заражении. Решающим в диагностике является патологоанатомическое или лабораторное подтверждение туберкулеза у убитых с диагностической целью особей.
В неблагополучных по заболеванию хозяйствах реагирующими также считают животных с увеличением толщины кожной складки на 3 мм и выше, но при этом их считают больными и подвергают убою в течение 14 суток.
Проведенный нами анализ эпизоотической ситуации по туберкулезу крупного рогатого скота показывает, что в последние годы в Российской Федерации увеличивается количество реагирующих животных с неспецифическими реакциями на туберкулин.
Так, за 2001–2017 гг., то есть за последние 17 лет, в нашей стране было выявлено всего 824168 реагирующих животных, из них в благополучных хозяйствах – 748813, или 90,8%, а в неблагополучных хозяйствах – 76355, или 9,2%. В благополучных хозяйствах выявляется более 90% реагирующих животных.
В этой связи на современном этапе борьбы с туберкулезом крупного рогатого скота наиболее актуальной проблемой является выявление реагирующих животных с неспецифической реакцией на туберкулин и совершенствование дифференциальной диагностики аллергических реакций в благополучных хозяйствах.
Анализ доступной литературы показывает, что со времени возникновения проблемы неспецифических реакций были предложены различные методы их дифференциации. Однако наибольшее признание и распространение во всем мире получил метод симультанной туберкулиновой пробы.
Симультанная проба с применением туберкулинов для млекопитающих и для птиц нашла широкое применение во многих странах мира. На целесообразность ее использования в качестве теста определения видовой специфичности аллергических реакций указывалось в резолюциях XVI (1948 г.) и XVII (1950 г.) генеральных сессий МЭБ.
В нашей стране симультанную пробу с использованием ППД для млекопитающих и комплексного аллергена из атипичных микобактерий (КАМ) внедрил в производство А.Н.Шаров в 1978 г. Первое наставление по применению симультанной пробы с туберкулином и КАМ было утверждено ГУВ МСХ СССР 27.11.1978 г., впоследствии оно было пересмотрено и утверждено 04.07.1980 г. Методика проведения симультанной пробы с КАМ для практического применения при диагностике туберкулеза была утверждена ГУВ МСХ СССР 28.12.1981 г.
В настоящее время в нашей стране основным методом дифференциации неспецифических реакций является симультанная проба с ППД для млекопитающих и КАМ с учетом результатов симультанной пробы по группе реагирующих животных.
Основным недостатком симультанной пробы является ее небольшая эффективность. Кроме того, в соответствии с наставлением по применению, при выявлении реагирующих на туберкулин животных необходимо через 30 дней переисследовать все стадо симультанной пробой с ППД для млекопитающих и КАМ. При этом учет результатов симультанной пробы и оценку аллергических реакций следует проводить в целом по стаду или по группе исследуемых животных не менее шести голов.
Проведение комплекса этих исследований – довольно длительный и трудоемкий процесс, так как приходится повторно исследовать все стадо двойной внутрикожной пробой. Тем более, что в последние годы при групповом учете симультанной пробы все чаще стали получать неопределенные результаты.
Проведенные нами многочисленные исследования по изучению возможности дифференциации неспецифических реакций показывают, что учет результатов симультанной пробы с ППД для млекопитающих и КАМ можно проводить по группе животных с оценкой реакции по реактивному числу, а при получении неопределенных результатов исследований – проводить индивидуальный учет по каждой корове.
Поэтому на основании представленных данных и собственных исследований мы предлагаем в целях контроля благополучия крупного рогатого скота по туберкулезу проводить ежегодные исследования поголовья два раза в год (весной и осенью) внутрикожной пробой с ППД для млекопитающих. При выявлении в стаде реагирующих особей дальнейшие исследования проводить симультанной пробой.
Методика проведения и оценка результатов симультанной пробы с ППД для млекопитающих и КАМ:
─ Проведение симультанной пробы допускается не ранее, чем через 30 дней после последней туберкулинизации животных.
─ ППД для млекопитающих и КАМ вводят каждому животному внутрикожно, в дозе по 0,2 мл, с правой и левой стороны тела животных: крупному рогатому скоту – в симметричные участки шеи; быкам-производителям – в правую и левую подхвостовые складки.
─ Предварительно места введения аллергенов выстригают и протирают ватными тампонами, смоченными 70 0 спиртом-ректификатом.
─ Учет и оценку результатов симультанной пробы проводят через 72 часа после введения аллергенов.
─ При учете результатов симультанной пробы у каждого исследуемого животного пальпируют место введения туберкулина. Реакцией считают любую припухлость в месте введения аллергена с увеличением толщины кожной складки на 3 мм и выше, независимо от характера этой реакции (консистенции, температуры, болезненности и т.д.)
─ Оценку результатов симультанной пробы проводят по индивидуальному учету.
Оценка результатов симультанной пробы по индивидуальному учету
Индивидуальную оценку интенсивности аллергических реакций проводят при наличии реагирующих животных на оба аллергена. Реакция на один из аллергенов считается более интенсивной, если при измерении утолщения кожной складки устанавливается разница не менее чем на 3 мм. Результаты оценки реакции на аллергены записывают в ведомость учета симультанной пробы. В случаях, когда интенсивность аллергической реакции более сильно выражена на ППД-туберкулин для млекопитающих, это животное считают подозреваемым в заражении возбудителем туберкулеза M.bovis или M.tuberculosis.
При более выраженной интенсивности аллергической реакции на КАМ животное считают сенсибилизированным нетуберкулезными микобактериями.
При отборе реагирующих особей для диагностического убоя в первую очередь убивают реагирующих с большей интенсивностью реакции на ППД для млекопитающих, а при отсутствии животных с такими реакциями диагностическому убою подвергают реагирующих животных с равными реакциями на оба аллергена.
Предлагаемая методика индивидуального учета симультанной пробы предназначается для отбора животных для диагностического убоя.
Преимущества этой методики применения симультанной туберкулиновой пробы заключаются в том, что нет необходимости переисследовать симультанной пробой все стадо. В конечном счете, диагноз на туберкулез ставится только при подтверждении результатов аллергических исследований результатами убоя реагирующих животных (при патологоанатомическом или лабораторном подтверждении). Так что следует считать, что симультанная проба применяется с целью отбора животных, которые наиболее характерно реагируют на ППД для млекопитающих, для диагностического убоя.
1. При групповом учете результатов симультанной пробы с ППД для млекопитающих и КАМ часто получают неопределенные результаты. Поэтому учет и оценку этих исследований необходимо проводить индивидуально по каждой реагирующей корове.
2. Индивидуальную оценку интенсивности проявления аллергических реакций необходимо проводить при выявлении реагирующих животных на оба аллергена.
3. Реакцию на один из аллергенов следует считать более интенсивной, если устанавливается увеличение толщины кожной складки не менее 3 мм, то есть, если реакция на ППД для млекопитающих на 3 мм и более выше, чем на КАМ, животное следует считать подозреваемым в заражении M. bovis или M. tuberculosis. При более выраженной реакции (на 3 мм и выше) на КАМ животное следует считать сенсибилизированным нетуберкулезными микобактериями.
Симультанную пробу с ППД для млекопитающих и КАМ следует применять в благополучных хозяйствах при выявлении реагирующих на туберкулин животных с целью отбора наиболее характерно реагирующих для диагностического убоя и последующих патологоанатомических и лабораторных исследований на туберкулез.
1. Гулюкин М.И. Методические наставления по проведению исследований при микобактериозах животных / М.И.Гулюкин, А.Х.Найманов, Н.П.Овдиенко [и др.]. – Москва, 2012. – 85 с.
3. Найманов А.Х. Проблема неспецифических реакций на туберкулин и совершенствование симультанной пробы для дифференциальной диагностики туберкулеза крупного рогатого скота / А.Х.Найманов, Г.И.Устинова, Н.Г. Толстенко [и др.] // Ветеринария. – 2015. – № 6. – С. 20 – 25.
4. Найманов А.Х. Совершенствование симультанной туберкулиновой пробы для дифференциации неспецифических реакций у крупного рогатого скота / А.Х.Найманов, Г.И.Устинова, Н.Г. Толстенко [и др.] // Ветеринария и кормление. – 2016. – № 1. – С. 11 – 13.
5. Найманов А.Х. Микобактериальные инфекции крупного рогатого скота (туберкулез и паратуберкулез) / А.Х.Найманов, М.И.Гулюкин. – Москва: Зооветкнига, 2014. – 235 с.
6. Найманов А.Х. Туберкулез животных / А.Х.Найманов, В.М.Калмыков. – Санкт-Петербург – Москва – Краснодар: Лань, 2018. – 504 с.
7. Помыканов Н.П. Совершенствование диагностики туберкулеза крупного рогатого скота в индивидуальных хозяйствах: автореф. дисс. канд. вет. наук. – Москва, – 2005. – 23 с.
8. Хасанов Н.Р. Совершенствование дифференциальной диагностики туберкулеза крупного рогатого скота: дисс. канд. вет. наук. – Душанбе, 2001. – 105 с.
9. Шаров А.Н. Аллергическая диагностика туберкулеза у животных: повышение ее эффективности: дисс. докт. вет. наук. – Москва, 1989. – 373 с.
Аллергическая диагностика. Основным методом прижизненной диагностики туберкулеза крупного рогатого скота является внутрикожная проба с ППД туберкулином для млекопитающих. В настоящее время туберкулин получают из культурального фильтрата микобактерий, выращенных на синтетической питательной среде, путем осаждения протеиновой фракции (PPD) трихлоруксусной кислотой и сульфатом аммония /А.С. Донченко, 1989; А.Н.Шаров, 1989; А.Х.Найманов, 1993; И.И.Румачик, 1993, 1997; Л.П.Ходун, 1997/.
Туберкулин, при внутрикожном введении, позволяет выявлять инфицированных животных задолго до появления других признаков заболевания. В тоже время эффективность метода во многом зависит от комплекса взаимосвязанных причин: степени распространения инфекции в стаде, характера течения туберкулеза, формы и вида персистирования микобактерий, от механизмов иммунного ответа, различия путей, доз и кратности инфицирования, времени года, физиологического состояния животных, их возраста.
В разных странах для аллергической диагностики туберкулеза крупного рогатого скота применяют дозы от 2000 до 10000 ME туберкулина для млекопитающих. Выбор дозы зависит от эпизоотической ситуации и иммунологической реактивности животных в конкретном регионе. Оптимальной считают такую дозу туберкулина, которая выявляет наибольшее число животных, зараженных возбудителем туберкулеза и минимальное количество здоровых особей или инфицированных атипичными микобактериями.
Существует мнение о том, что при уменьшении дозы туберкулина ниже 10000 МЕ, часть зараженных животных может не реагировать и остается в стаде, что растягивает сроки оздоровления. Однако в стадах с сильным распространением болезни туберкулин в дозе 10000МЕ одномоментно не выявляет всех инфицированных животных, а средняя чувствительность теста составляет 70-77%. Вместе с тем, регулярная туберкулинизация с интервалом в 30-60 дней позволяет выявить практически всех инфицированных и больных животных. Истинная анергия отмечается не более, чем у 3-4% больных коров.
В неблагополучных по туберкулезу хозяйствах допускается применение двукратной туберкулиновой пробы с целью максимального выявления реагирующих животных (гипердиагностика), которая ранее была обязательной при исследовании скота на туберкулез во всех категориях хозяйств. При учете реакций на первое введение через 72 часа нереагирующим животным повторно вводят туберкулин в той же дозе и в то же самое место и реакции учитывают через 24 часа.
Согласно рекомендаций (МЭБ, 1996), в странах ЕС доза туберкулина была снижена до 2000-2500 МЕ. Для Белоруссии, при улучшении эпизоотической ситуации, оптимальной дозой может быть 5000 МЕ, использование которой без существенного снижения чувствительности на 30-50% уменьшает число неспецифических реакций на туберкулин.
Аллергические реакции на туберкулин у животных могут быть обусловлены не только возбудителем туберкулеза, но и атипичными микобактериями. Обычно применяемая внутрикожная туберкулиновая проба не дает возможности дифференцировать парааллергические реакции у крупного рогатого скота. /А.С. Донченко, 1989; А.И.Завгородний, 1987; А.Н.Шаров, 1989; Ю.Я. Кассича, 1990; А.Х.Найманов, 1993; И.И.Румачик, 1993, 1997; Л.П.Ходун, 1997/.
Для прижизненной дифференциальной аллергической диагностики у животных и птиц применяется симультанная внутрикожная проба: введение туберкулина для млекопитающих как основного аллергена для выявления больных туберкулезом животных (у птиц - туберкулина для птиц), и другого аллергена (туберкулина для птиц, КАМа, других сенситинов), способного в большей степени выявлять особи, инфицированные другими (нетуберкулезными) видами микобактерий. Препараты вводят внутрикожно в симметричные участки шеи с разных сторон. Учет реакции проводят через 72 часа, сравнивая наличие и интенсивность реакций. При отсутствии в стаде туберкулезной инфекции интенсивность реакций у животных будет более выражена на КАМ или туберкулин для птиц, и, наоборот, - при наличии туберкулезной инфекции в стаде - на туберкулин для млекопитающих.
Для дифференциации парааллергических туберкулиновых реакций в ветеринарной практике уже давно используется симультанная проба с применением туберкулина для птиц. /Г.В.Чепик, 1980; И.И.Румачик, 1993, 1997/. Оценку результатов этой пробы проводится по количественному и качественному проявлению реакции на туберкулин как в целом по стаду, так и индивидуально по каждому животному. Животные, инфицированные возбудителем туберкулеза или атипичными микобактериями, реагируют на гомологичный туберкулин в большем количестве и интенсивнее. Преимущественное реагирование крупного рогатого скота только на ППД туберкулин для птиц (более 85%) и незначительное (до 15%) его реагирование на оба туберкулина, при более выраженной интенсивности реакций на туберкулин для птиц и отсутствие или наличии единично реагирующих животные только на ППД туберкулин для млекопитающих со слабо выраженными реакциями, давали основание для предварительного заключения об инфицированности скота данного стада атипичными микобактериями (возбудитель туберкулеза птичьего вида - M.avium -отнесен к III группе атипичных микобактерий по классификации Runyon (1959 г.).
И наоборот, если имеет место преимущественное реагирование скота на ППД туберкулин для млекопитающих, то можно предварительно судить об инфицированности (или заболевании) животных возбудителем туберкулеза (M.bovis или M.tuberculosis).
Если животные реагировали в одинаковой степени на оба туберкулина без какой-либо закономерности, то можно было предположить, что в стаде (на ферме) имеет место смешанная микобактериальная инфекция, т.е. инфицирование животных возбудителем туберкулеза бычьего или человечьего вида и одновременно атипичными микобактериями.
Комплексный аллерген из атипичных микобактерий (КАМ), разработанный и внедренный в практику в конце 70-х годов (А.Н.Шаров, 1979, 1980), получил широкое применение для дифференциальной диагностики туберкулеза крупного рогатого скота в симультанной аллергической пробе. Симультанную аллергическую пробу с КАМ проводят в соответствии с наставлением. Ее применение рекомендовано через 30-45 дней после первого (или второго) планово исследования при условии выделения реагирующих на туберкулин животных. Хотя в приложении к инструкции (1988 г.) указывается на возможность проведения первичного исследования поголовья сразу симультанно, если ранее постоянно выявлялись реагирующие на туберкулин животные, но бактериологическим исследованием материала от них, диагноз не был подтвержден, а были выделены атипичные микобактерии.
Проводимые сравнительные испытания эффективности ППД туберкулина для птиц и КАМ в симультанной аллергической пробе у крупного рогатого скота явного предпочтения одному из них не дали. Эти аллергены могут в одинаковой степени быть использованы для дифференциации туберкулиновых реакций у скота. Однако обе методики - как с КАМ, так и с туберкулином для птиц - не лишены недостатков.
При математическом анализе результатов симультанной пробы и оценки достоверности интенсивности реакций с КАМ не принимаются во внимание животные, реагирующие только на КАМ и с одинаковой интенсивностью реакций на оба аллергена; при использовании методики симультанной пробы с туберкулином для млекопитающих не учитывались реагирующие только на туберкулин для млекопитающих, только на туберкулин для птиц и реагирующие на оба туберкулина в одинаковой степени. Учитывались только животные, реагировавшие одновременно на оба туберкулина с разной интенсивностью реакций. Такой методический подход более правильный.
Для массовой аллергической диагностики предложен также "Туберкулин очищенный для млекопитающих" Разработанный препарат обладает целым рядом преимуществ, в том числе и по стоимости. "Туберкулин очищенный для млекопитающих" за счет очистки методом ультрафильтрации и высокой специфической активности на 30% дешевле ППД туберкулина. Апробация препарата более, чем на 10000 головах крупного рогатого скота в хозяйствах с разной эпизоотической ситуацией показала, что при равной специфичности с ППД туберкулином Курской биофабрики он обладает достоверно большей специфической активностью, то есть полнее выявляет больных животных в неблагополучном стаде /А.П.Лысенко, Т.Н.Агеева, Г.В.Карпова и др.1997; А.Н.Притыченко, 2002/.
Особенностью аллергической диагностики туберкулеза у свиней является то, что у этого вида животных до сих пор применяется введение одновременно (симультанно) двух аллергенов: ППД туберкулинов для млекопитающих и для птиц. А поскольку в республике туберкулез у свиней отсутствует, то, естественно животные реагируют, в основном, на туберкулин для птиц. Это создает много искусственно надуманных, ничем научно и практически необоснованных ситуаций. В инструкции и наставлении по туберкулезу животных много в этом плане противоречивых пунктов, хотя диагноз на туберкулез у свиней устанавливается на основании п.3.3. Следует в то же время отметить, что у крупного рогатого скота при инфицировании его атипичными микобактериями, в том числе и возбудителем туберкулеза птичьего вида, никаких ограничений не устанавливается (п. 6.6 инструкции), даже молоко от таких животных (стад) идет на общих основаниях.
Анализ научно-практической работы по туберкулезу свиней позволил нам сделать заключение о том, что этот вид животных достаточно исследовать на туберкулез аллергически только одним туберкулином для млекопитающих и это не приведет к ущербу в диагностике и профилактике туберкулеза.
Туберкулез – широко распространенное инфекционное заболевание человека и жи-вотных, вызываемое микобактериями туберкулезного комплекса (Mycobacterium tubercu-losis complex – MTBC). От больных туберкулезом животных могут заражаться люди, для них наиболее опасны Mycobacterium bovis (микобактерии туберкулеза бычьего). От лю-дей, больных туберкулезом, микобактериями туберкулеза человека – Mycobacterium tu-berculosis может заражаться крупный рогатый скот. Диагноз на туберкулез у крупного ро-гатого скота ставят на основании результатов аллергических, патолого-анатомических, гистологических и бактериологических исследований с учетом эпизоотологических данных и клинических признаков.
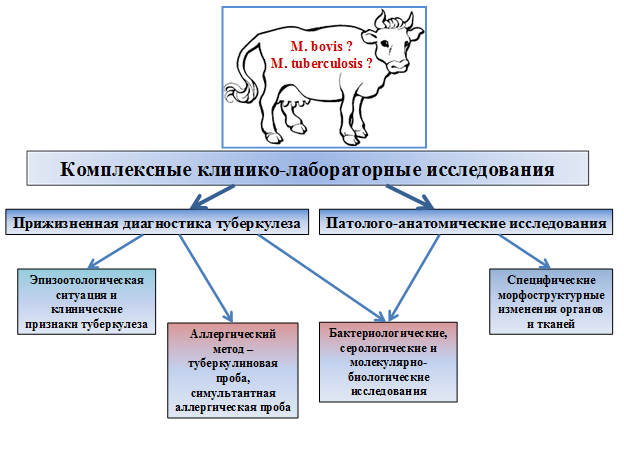
Рис. 1. Схема комплексных исследований крупного рогатого скота на туберкулез
Прижизненная диагностика туберкулеза у крупного рогатого скота проводится аллергическим методом.
Аллергический метод – внутрикожная туберкулиновая проба с применением Пурифиед Протеин Дериватив – туберкулина (ППД-туберкулин) для млекопитающих. Туберкулин вводят крупному рогатому скоту в середину шеи (рис. 2). Учет и оценку реакции на введение туберкулина проводят через 72 часа. Животных считают положительно реагирующими на туберкулин при утолщении кожной складки на 3 мм и более. Толщину кожной складки в месте введения туберкулина измеряют кутиметром, а полученный показатель сравнивают с толщиной кожной складки рядом с местом введения препарата [3, 4].

Рис. 2. Туберкулиновая проба у крупного рогатого скота [6]
Для дифференциации парааллергических реакций у крупного рогатого скота используется симультанная проба с одновременным применением двух туберкулинов – для млекопитающих и для птиц или туберкулина для млекопитающих и комплексного аллергена из атипичных микобактерий (КАМ).
Симультанная проба проводится в том же порядке, что и туберкулиновая (рис. 3). Проба является групповой и дает возможность оценить ситуацию по туберкулезу лишь в целом по стаду или по группе (не менее 6 голов) обследуемых животных. Под достоверностью различия понимают такое различие в величине показателей интенсивности реакций на туберкулин и КАМ, которое дает возможность с уверенностью не менее чем на 95 % сделать заключение о состоянии по туберкулезу обследуемой группы животных [3].
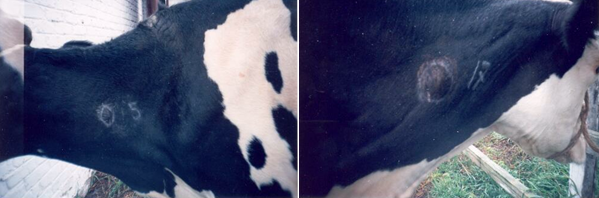
Рис. 3. Симультанная аллергическая проба с использованием ППД-туберкулина и комплексного аллергена из атипичных микобактерий [11]
Офтальмопроба на туберкулез (глазной метод туберкулинизации).
Туберкулин в количестве 3–5 капель наносится на конъюнктиву нижнего века или на поверхность роговицы глаза животного. Проводится офтальмопроба двукратно с 5–6-дневным интервалом [2, 4, 5]. Результаты офтальмопробы оценивают через 6, 9, 12 и 24 часа после первого и через 3, 6, 9 и 12 часов после повторного введения туберкулина. Реакция считается положительной, если образуется гнойный или слизисто-гнойный секрет, который накапливается в конъюнктивальном мешке или вытекает в виде шнура из внутреннего угла глаза. Кратковременная гиперемия слизистых оболочек глаза и слезотечение с образованием небольшого количества слизистого секрета рассматриваются как отрицательная реакция [3].
Факторы, обуславливающие проявление неспецифических реак-ций на туберкулин у КРС
В многочисленных исследованиях было показано, что проявления неспецифических реакций на туберкулин у крупного рогатого скота обусловлены многочисленными факторами внешней среды и индивидуальными особенностями организма животного [2, 3, 5]. Неспецифические реакции подразделяются на две основные группы: парааллергические и псевдоаллергические (см. таблицу).
Причины возникновения неспецифических реакций у крупного рогатого скота на введение туберкулина
| Неспецифическая реакция | Фактор, обуславливающий проявление неспецифической реакции | Особенности неспецифической реакции |
|---|---|---|
| Парааллергическая | Атипичные (нетуберкулезные) виды микобактерий и их ассоциации.
Mycobacterium tuberculosis (микобактерии туберкулеза человека). Mycobacterium avium (микобактерии туберкулеза птичьего) | Непостоянство реакции на туберкулин.
Сенсибилизация организма животного сохраняется от 1 до 3 месяцев после инфицирования [5]. Выявление наибольшего количества животных с выраженными реакциями на КАМ |
| Псевдоаллергическая | Наличие гельминтов (фасциол, дикроцелий, эхинококков). Актиномикоз. Микологические поражения легких. Гнойные или гнойно-некротические процессы во внутренних органах. Нарушения обмена веществ | В благополучных по туберкулезу стадах у отдельных животных регистрируется увеличение толщины кожной складки на месте введения туберкулина на 3–4 мм, признаки воспаления отсутствуют |
Лабораторные методы диагностики туберкулеза КРС
К лабораторным методам диагностики туберкулеза относятся бакте-риологическое исследование, серологическое исследование и молеку-лярно-биологическое исследование.
Бактериологическое исследование проводится с целью выделения возбудителя туберкулеза (рис. 4).
Отбор проб биоматериалов для бактериологического исследования производят как от животных с клиническими признаками туберкулеза, так и от животных, вызывающих подозрение на туберкулез. Исследуют молоко, мокроту, мочу. От павших и убитых животных для исследования отбирают пораженные участки органов на границе со здоровой тканью и измененные лимфатические уз-лы.
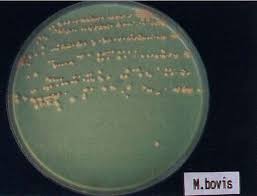
Рис. 4. Культура Mycobacterium bovis. Среда роста Гельберга [10]
При наличии характерных для туберкулеза изменений исследуются портальные, предлопаточные, надвыменные, поверхностные паховые лимфатические узлы и фрагменты внутренних органов – легких, печени, почек.
Бактериологическое исследование биоматериалов на туберкулез за-нимает срок до 3 месяцев. Заболевание животных туберкулезом считается установленным в случаях выделения микобактерий туберкулеза бычьего или человеческого из материала от убитых животных [3, 4, 8].
Серологическое исследование на туберкулез проводится в реакции связывания комплемента (РСК).
РСК применяется в двух вариантах:
1) для обнаружения в сыворотке больного животного специфических антител к возбудителю туберкулеза;
2) для выявления и идентификации в исследуемом материале антигена возбудителя туберкулеза.
Молекулярно-биологическое исследование на туберкулез.
Полимеразная цепная реакция (ПЦР) является одним из высокочувствительных и специфичных методов диагностики туберкулеза. Чувствительность метода ПЦР – от 10 до 100 микроорганизмов в пробе (чувствительность микроскопического метода – от 103 до 105 микроорганизмов). В основе метода лежит амплификация специфических участков ДНК возбудителя, которые содержатся в исследуемой пробе. В настоящее время в лабораторной практике применяются тест-системы как для выявления ДНК конкретного вида, так и для дифференцирования видов, входящих в Mycobacterium tuberculosis complex: микобактерий человеческого вида (M. tuberculosis), бычьего вида (M. bovis) и вакцинного штамма микобактерий бычьего вида (M. bovis BCG). Для проведения анализа используют следующие образцы биопроб от крупного рогатого скота: цельную кровь, молоко, фарингеальные смывы, мочу, фекалии, носовую слизь и биопсийные материалы, в том числе лимфатические узлы [3].
Молекулярно-биологическое исследование позволяет значительно ускорить раннюю диагностику туберкулеза, дифференцировать пара- и псевдоаллергические реакции на туберкулин, снизить количество подозреваемых в заражении туберкулезом и подвергаемых диагностическому убою животных [4, 5].
Патолого-анатомические исследования
Для убоя с диагностической целью отбирают животных по результатам вышеизложенных методов исследования.
Патолого-анатомические изменения в организме больного туберкулезом животного зависят как от его возраста, так и от стадии инфекционного процесса.
В начальных стадиях инфекционного процесса туберкулы имеют вид серых полупрозрачных узелков размером от булавочной головки до чечевичного зерна. Затем они становятся мутными, приобретают бело-желтый цвет, заполняются некротизированной сухой творожистой массой. В легких туберкулезные очаги поражения чаще выделяются над плеврой по тупому краю органа (рис. 5).
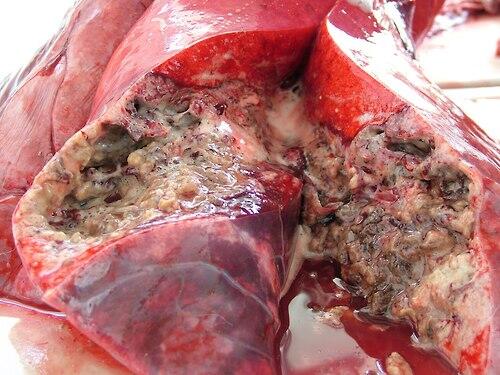
Рис. 5. Легкое крупного рогатого скота при туберкулезном поражении тканей [9]
Гистологические исследования проводят для дифференциации туберкулезных патолого-анатомических изменений от сходных изменений, наблюдаемых при других заболеваниях, например для дифференциации от гранулем паразитарного и микотического происхождения. В положительных случаях в гистологических препаратах, окрашенных по Цилю – Нильсену, находят гранулемы с некротизированным центром, окруженные зоной эпителоидных, отдельных гигантских лимфоидных клеток и соединительно-тканной капсулой.
Вместо заключения
Осуществление плановых профилактических диагностических иссле-дований на туберкулез способствует снижению риска инфицирования людей туберкулезом, ограничению распространения возбудителя из очагов инфекции, раннему выявлению неблагополучных по туберкулезу населенных пунктов.
Читайте также:


