Наборы для пцр диагностики при туберкулезе

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
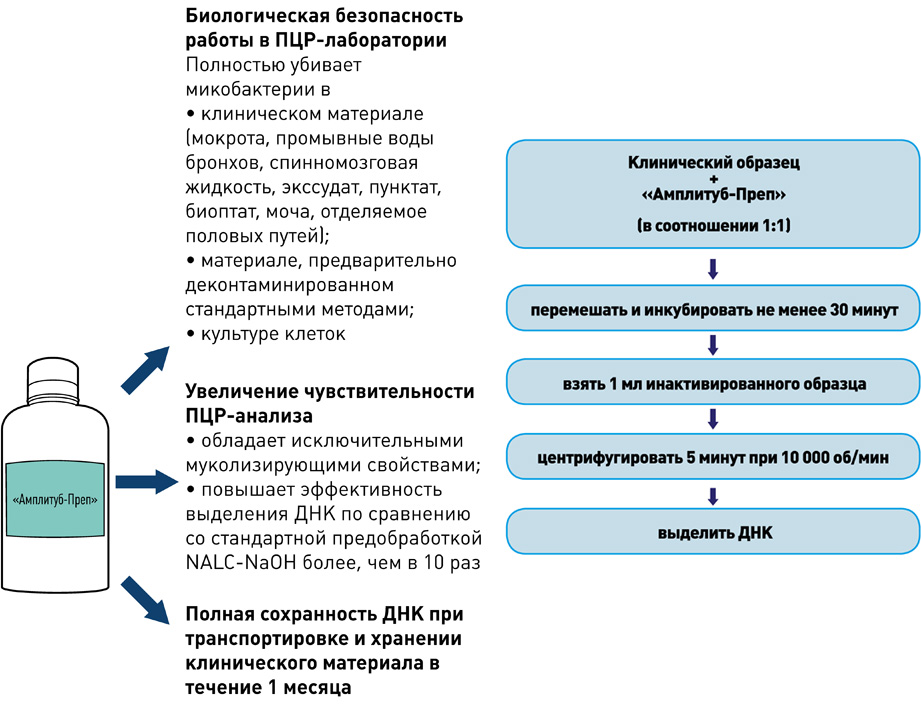
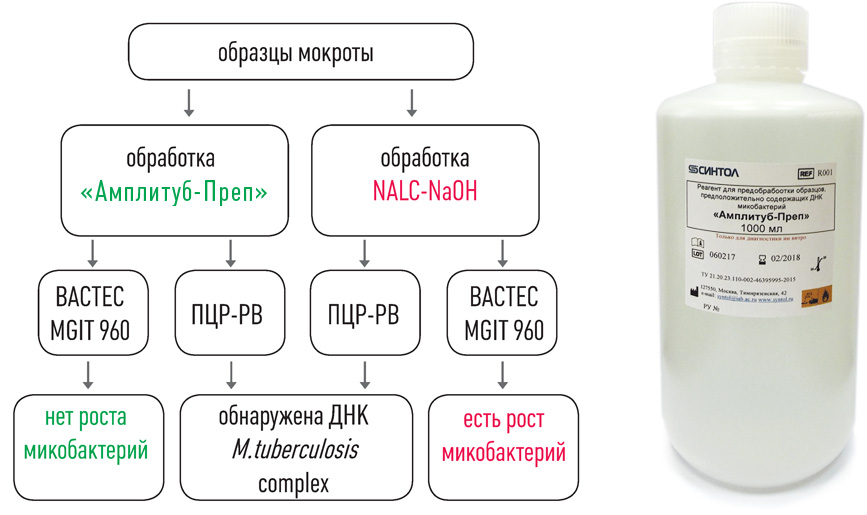
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
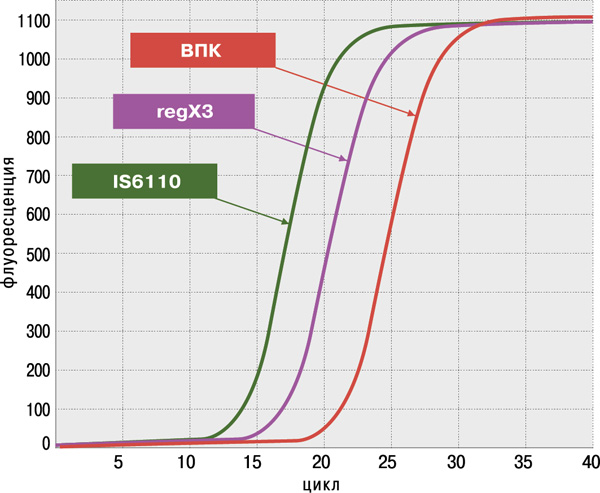
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
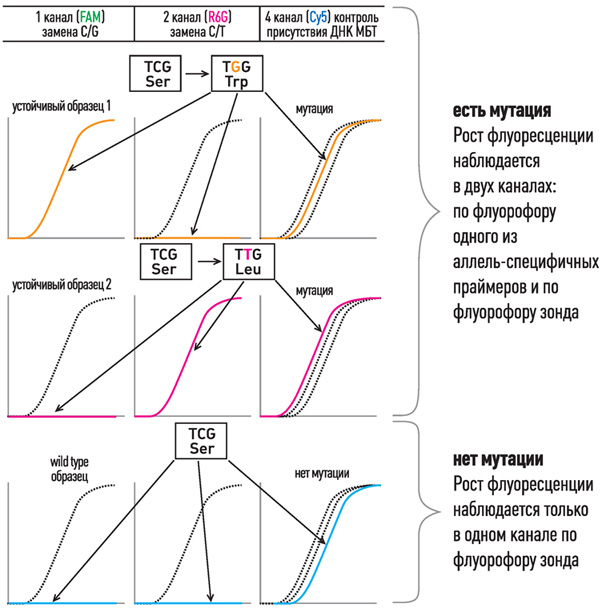
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
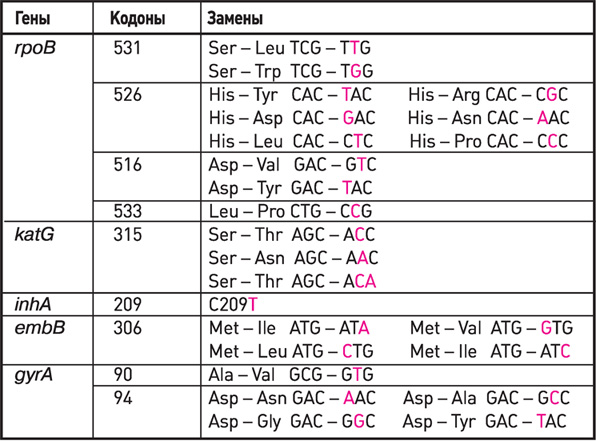
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
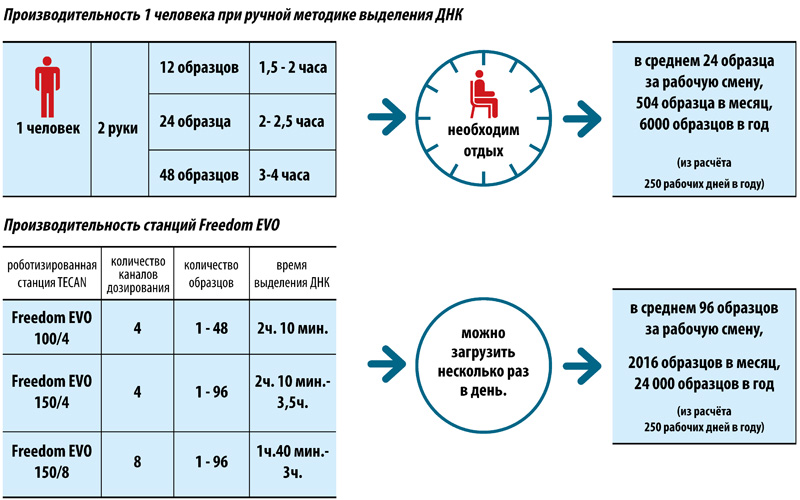

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Полимеразная цепная реакция (далее ПЦР) — это высокоточный метод молекулярно-генетического исследования материла, который позволяет выявить у человека различные инфекционные заболевания и установить генотип возбудителя.
ПЦР для выявления различных заболеваний стала применяться в самом конце прошлого века. Первооткрывателем этого метода исследования является американский биохимик Кэри Муллис. Свое открытие он сделал в 1983 году. Но еще несколько лет понадобилось, чтобы доработать метод.
Суть метода
С помощью ПЦР-диагностики можно обнаружить фрагменты чужеродного ДНК в любой жидкой среде организма. На анализ могут быть взяты такие жидкости:
- Кровь.
- Слюна.
- Мокрота.
- Выделения из половых органов.
- Смывная жидкость бронхов.
- Желудочный сок.
Лечащий врач сам определяет, какую биологическую жидкость лучше взять на анализ при конкретном заболевании.

ПЦР-диагностика позволяет не только обнаружить микрофрагменты чужеродной ДНК, но и определить к какому конкретному виду она относится. То есть с помощью ПЦР можно не только точно установить возбудителя заболевания, но и выяснить к какому виду он принадлежит.
Процесс анализа ПЦР — очень сложный. Он состоит из нескольких этапов:
- Сначала нужно обнаружить фрагменты вредоносной ДНК в предоставленном образце.
- Копирование фрагмента ДНК. Маленького участка ДНК для анализа недостаточно, поэтому его копируют. Нуклеиновая кислота может копироваться в пробирке с помощью фермента полимеразы (вне живого организма). В пробирке образуется множество клонов, то есть происходит цепная реакция. Весь процесс происходит в три этапа под воздействием различных температур.
- Когда генетического материала становится достаточно для исследования, тогда возбудитель определяется обычными методами.
Метод ПЦР очень точен и может выявить наличие любого возбудителя по небольшому фрагменту ДНК или РНК.
ПЦР-исследование туберкулеза
ПЦР-анализ на туберкулез является самым информативным методом диагностирования этого заболевания. Относительно туберкулеза этот метод позволяет не только установить наличие микобактерий в организме, но и определить к какому виду они принадлежат.
Результат ПЦР диагностики может быть простой и расширенный. В простом результате указывается только наличие/отсутствие микобактерии. Расширенный результат дает представление о дополнительных параметрах протекания заболевания. Правильно понять, что написано в результате анализа ПЦР может только фтизиатр.
ПЦР-диагностика туберкулеза не проводится всем без исключения. Это объясняется дороговизной реактивов и недоступностью проведения исследования в некоторых отдалённых районах (в таких местах пользуются другими методами диагностики).

Показаниями для проведения ПЦР-исследования являются:
- Длительный контакт с больным туберкулезом.
- Беременность. ПЦР крови на туберкулез является самым быстрым и безопасным методом для беременной женщины.
- Экстренная ситуация. Например, необходимость срочного оперативного вмешательства, при котором нужно точно установить наличие/отсутствие туберкулеза в организме.
- Аллергическая реакция на туберкулиновые пробы.
- ВИЧ-инфекция.
- Невозможность диагностирования заболевания другими способами, при наличии явных признаков туберкулеза.
- Неоднозначные симптомы, которые не позволяют создать четкую клиническую картину заболевания (болезни верхних дыхательных путей, сопровождающиеся большим количеством мокроты, кровохарканьем и пр.).
Метод ПЦР, при всей своей сложности и дороговизне, проводится и расшифровывается в течение нескольких часов. Что делает этот метод золотым стандартом при диагностике туберкулезной инфекции.
Забор материала — это первый этап при выполнении ПЦР-исследования. Для того, чтобы выполнить качественный анализ, нужно соблюдать определенные правила по сбору материла:
- Для ПЦР мокроты на туберкулез нужно тщательно провести туалет полости рта. Делать это нужно вечером и утром перед анализом. Все это время не есть. Вечером выпить муколитическое средство для лучшего отхождения мокроты.
- Перед сдачей крови на ПЦР нужно не употреблять пищу в течение 8 часов. Лучше всего производить забор крови утором натощак. Курить перед забором крови также нельзя. Кровь берется из вены на локтевом сгибе руки в стерильную пробирку. В эту же емкость добавляется антикоагулянт, чтобы кровь оставалась жидкой. Смешивать антикоагулянт с кровью нужно очень аккуратно, не делая резких движений. Если кровь была взята не в лабораторных условиях, то она должна быть предоставлена лаборанту до истечения пятичасового срока. Иначе результат может быть не точным.
- Моча собирается в стерильную емкость утром, до приема пищи. Перед сбором мочи необходим тщательный туалет промежности.
- Остальные виды жидкостей (смывы с бронхов, спинномозговая жидкость) может собрать только специалист в условиях стационара.
- Перед забором жидкостей на ПЦР-исследование запрещено принимать некоторые препараты (например, прием некоторых антибиотиков нужно прекратить за две недели до забора материала).
- Требования к лаборатории, в которой проводится забор анализов на ПЦР очень строгие. Лаборатория должна быть стерильна, чтобы не произошло перекрестное загрязнение материала. В этом случае результаты могут быть ложноположительными.
ПЦР-тест на туберкулез — высокоточный информативный анализ. И требования к его проведению крайне строгие. Чтобы анализ получился, нужно соблюдать регламент.
Для работы в ПЦР-лаборатории приглашаются специально обученные врачи: бактериологи, вирусологи, микробиологи. Все они прошли дополнительное обучение для работы на сложном оборудовании.

Лаборатория должна иметь лицензию на выполнение работ связанных с бактериологически-опасными вирусами и бактериями.
В самой лаборатории должны быть выделены такие рабочие зоны:
- Зона приемки и сортировки проб.
- Зона подготовки проб. В этом помещении выделяются нуклеиновые кислоты из образцов материала.
- Зона проведения реакционных проб.
- Зона для учета результатов и расшифровки анализов.
Все помещения располагают последовательно. Допуск в эти зоны разрешен только работающим там сотрудникам, которые при входе соблюдают правила личной защиты от бактерий и вирусов.
Лучше, если есть возможность расположить лабораторию в отдельно стоящем здании с собственной системой вентиляции.
В лаборатории соблюдаются стерильные условия работы, чтобы избежать перекрестного загрязнения проб. Даже если один фрагмент чужеродной ДНК попадет в исследуемый материал, ПЦР его размножит, и анализ получится ложноположительным.
В каждой зоне лаборатории имеется свой набор оборудования и посуды для проведения исследований. Также имеются свои холодильники, которые не могут быть использованы в других целях, кроме хранения материала конкретной зоны исследований.
Использованные расходные материалы и остатки биологического материала уничтожаются специальными способами, в соответствии с инструкциями.
Плюсы ПЦР-диагностики
ПЦР-тест на туберкулез имеет множество плюсов, которые делают этот метод диагностики все более востребованным:
- Срок проведения. Несмотря на сложность проведения анализа, он готовится намного быстрее других лабораторных методов диагностики туберкулеза (около пяти часов). Это свойство анализа ПЦР становится особенно важным, когда анализ необходимо провести экстренно.
- Анализ ПЦР абсолютно безопасен и может проводиться беременным женщинам и детям.
- ПЦР-исследование можно сделать, когда по каким-то причинам нельзя выполнить другие методы диагностики.
- С помощью ПЦР-диагностики можно провести исследование любой биологической жидкости на выбор. В некоторых случаях это имеет большое значение.
- Позволяет обнаружить возбудителя на любой фазе заболевания. Даже после проведенного лечения, сохранившиеся остатки ДНК мертвых микобактерий будут обнаружены.
- Высочайшая чувствительность этого метода позволяет обнаруживать в биологическом материале даже единичные фрагменты ДНК микроорганизмов.
- Метод ПЦР позволяет не только обнаружить присутствие заболевания, но и может определить генотип возбудителя, отличив его от похожих микроорганизмов.
- ПЦР-исследование очень эффективно при рецидивирующем течении заболевания.
- Благодаря высочайшей чувствительности, анализ ПЦР может распознать микобактерии в организме человека, когда он только недавно инфицировался туберкулезом, задолго до появления клинических симптомов.
Казалось бы, метод ПЦР-диагностики содержит в себе только плюсы, но это не так.

Минусы ПЦР-диагностики
Минусы этого метода исследования тоже существенны. При выборе метода исследования туберкулеза это также стоит учитывать:
- Это дорогостоящий метод исследования. Для проведения ПЦР-диагностики нужна специально-оборудованная лаборатория. Оборудование для таких исследований стоит очень дорого, и не во всякой лаборатории оно имеется. В крайнем случае, можно обратиться в платную лабораторию.
- Сразу же после проведенного лечения метод ПЦР применять не рекомендуется. В крови пациента некоторое время сохраняется небольшое количество живых и мертвых микобактерий. Если провести анализ в этот период, он покажет ложноположительный результат.
- При мутациях микобактерий, анализ будет недостоверным, так как нормальная ДНК не сможет синтезироваться.
- Для ПЦР-исследования имеет значение правильный выбор биологической жидкости на анализ.
- Сверхчувствительность. Это тот случай, когда достоинство метода становится его недостатком. Если при проведении анализа в биологический материал каким-то образом попадет даже единичный фрагмент чужеродного ДНК, то ПЦР его размножит, и будет получен ложный результат.
Где пройти ПЦР-исследование на туберкулез
ПЦР-лаборатория имеется только в крупных противотуберкулезных диспансерах и диагностических центрах.

Объясняется это высокой стоимостью оборудования и высокими требованиями к содержанию лаборатории (реактивы, обработка).
Медицинские чиновники не сильно переживают из-за отсутствия ПЦР-лаборатории в каком-то конкретном населенном пункте, поскольку анализы на туберкулёз можно провести другими методами (культивирование микобактерий, микроскопическое исследование).
Если в населённом пункте нет бесплатной ПЦР-лаборатории, пациент по желанию может обратиться в платное учреждение.
В последнее время ПЦР-диагностика занимает все более прочные позиции в диагностике туберкулеза и других заболеваний, отодвигая на задний план другие методы диагностики.
Исследование для выявления возбудителя туберкулеза (Mycobacterium tuberculosis), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется генетический материал (ДНК) микобактерии в образце биоматериала.
Туберкулез, микобактерии туберкулеза, палочка Коха.
Tuberculosis, Tubercle bacillus, Koch's bacillus.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Биоптат, венозную кровь, ликвор, мокроту, плевральную жидкость, первую порцию утренней мочи, эякулят.
Общая информация об исследовании
Туберкулез (от лат. tuberculum – "бугорок") – инфекционное заболевание человека и животных, передающееся преимущественно воздушно-капельным путем. Риск заразиться повышает подавление иммунитета, вызванное ВИЧ/СПИДом, диабетом, заболеванием почек, трансплантацией органов и применением иммуносупрессоров, беременностью, старением. Кроме того, наиболее подвержены ему те, кто контактирует с больными туберкулезом, а также дети до 5 лет после виража туберкулиновой пробы. К наиболее уязвимым группам населения относят бездомных, заключенных, мигрантов из стран с высокой заболеваемостью туберкулезом, наркопотребителей, а также пожилых людей.
Для данного исследования используется тест-система, основанная на выявлении геномной ДНК возбудителя туберкулеза с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени (реал-тайм ПЦР). В современной диагностике это один из самых быстрых, универсальных и высокочувствительных методов.
Стандартные способы обнаружения микобактерий туберкулеза базируются на выращивании патогенных микроорганизмов в питательной среде. Сложности связаны с низкой скоростью роста колоний Mycobacterium tuberculosis – необходимо ожидать до 1,5 месяцев после взятия материала.
Высокой чувствительностью и специфичностью обладают молекулярно-биологические методы, основанные на детекции генетического материала микобактерий туберкулеза. Их важнейшим преимуществом является высокая скорость получения результата. Использование ПЦР реал-тайм позволяет выявить возбудитель туберкулеза уже в день получения клинического образца.
Бактериемия (попадание в кровь пациента микобактерий) может возникать на ранних стадиях туберкулезной инфекции, а также при развитии генерализованного или внелегочного туберкулеза. Она опасна тем, что иммунный ответ на бактерии вызовет сепсис и септический шок, чреватый смертью. Риск развития генерализованного туберкулеза наиболее высок у пациентов с ВИЧ на поздних стадиях, у тех, кто прервал противотуберкулезную терапию, а также у не обратившихся вовремя за медицинской помощью при появлении симптомов туберкулеза.
Диагностика туберкулеза у ВИЧ-инфицированных затруднена из-за иммуносупрессированного состояния организма, что зачастую проявляется в ложноотрицательных результатах туберкулиновых реакций и микробиологических тестов. В связи с этим тестирование на Mycobacterium tuberculosis методом ПЦР реал-тайм имеет большое значение.
Для чего используется исследование?
- Для диагностики туберкулеза легких (в частности, его генерализованных и внелегочных, связанных с бактериемией, форм), и контроля за его лечением.
Когда назначается исследование?
- При подозрении на внелегочный туберкулез.
- При симптомах бактериемии на фоне туберкулезной инфекции: повышенной температуре тела, потливости и пр. (при небольшом количестве бактерий в крови бактериемия может протекать бессимптомно).
- Если у пациента был длительный контакт с больным туберкулезом.
- При ненормальной реакции на туберкулиновую пробу у детей.
- Когда у пациента ВИЧ-инфекция.
Что означают результаты?
Референсные значения: отрицательно.
- Наличие возбудителя в исследуемом биоматериале. Это обычно встречается при активной форме туберкулеза, требующей лечения. Выявление большого количества микобактерий чаще всего указывает на внелегочную форму туберкулеза либо генерализацию инфекции.
- Возбудителя туберкулеза не выявлено. Бактериемия отсутствует.
Что может влиять на результат?
Эффективная противотуберкулезная терапия со временем приводит к исчезновению микобактерий в клиническом материале.
- Для назначения корректной схемы лечения при выявлении у пациента туберкулеза необходимо провести тест на чувствительность микобактерий к противотуберкулезным препаратам.
Кто назначает исследование?
Врач общей практики, терапевт, фтизиатр, уролог, гинеколог, инфекционист.
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
Реагенты и оборудование для предобработки биоматериалов и экстракции ДНК
| Наборы реагентов для экстракции ДНК из мокроты, бронхо-альвеолярного лаважа, мочи, синовиальной жидкости и смывов с объектов окружающей среды | АмплиПрайм ДНК-сорб-В и АмплиПрайм РИБО-преп |
| Реагент для разжижения мокроты и синовиальной жидкости | Муколизин |
| Набор для экстракции ДНК, используемый при исследовании биоптатов (легкие, лимфатические узлы, почки, печень, мозг, селезенка) | ДНК-сорб-С |
| Оборудование для гомогенизации биоптатов | TissueLyser LT или TissueLyser II |
| Парафиновые блоки нарезают на микротоме или вырезают фрагмент ткани одноразовым скальпелем, а затем проводят экстракцию ДНК, например, с помощью набора реагентов QIAamp DNA FFPE Tissue Kit (50) | QIAamp DNA FFPE Tissue Kit (50) |
Наборы реагентов для ПЦР-диагностики туберкулеза
Применение молекулярно-биологических методов (в частности, выявление ДНК методом ПЦР) в диагностике туберкулеза регламентировано Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009).
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii).
Микобактерии туберкулеза выявляются без видовой дифференциации; микобактерии, не относящиеся к MTC (например, M.avium и M.paratuberculosis) - не выявляются. Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала.
Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений.
С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Определение лекарственной устойчивости туберкулеза
Распространение штаммов туберкулеза с лекарственной устойчивостью, в том числе с множественной лекарственной устойчивостью (МЛУ, или MDR) составляет одну из серьезнейших проблем современного здравоохранения. Определение лекарственной устойчивости туберкулеза с помощью молекулярно-биологических методов всё шире применяется ввиду высокой скорости получения результатов (1-2 дня), что становится возможным благодаря использованию не только первичной культуры, но и непосредственно клинического материала.
Важно понимать, что наборы реагентов, основанные на разных молекулярно-биологических методах, характеризуются разными показателями диагностической чувствительности и специфичности.
| Наименование набора реагентов | АмплиСенс® MTC-Rif-Seq | АмплиСенс® MTC-PZA-Seq |
| Исследуемый ген | rpo B | pnc A |
| Препараты, к которым определяется устойчивость | рифампицин | пиразинамид |
| Кол-во выявляемых мутаций | более 200 | более 500 |
Наборы включают реагенты для амплификации фрагментов ДНК микобактерий туберкулеза, очистки продуктов амплификации (сорбентным методом), определения концентрации очищенного продукта амплификации и праймеры для секвенирования. Наборы для экстракции ДНК (АмплиПрайм РИБО-преп или ДНК-сорб-С ) и реагенты для проведения реакции секвенирования приобретаются отдельно.

Нормативные документы, публикации, информационные материалы >>
За звучной аббревиатурой ПЦР скрывается сложная и не слишком понятная для рядового пациента расшифровка — полимеразная цепная реакция. Что же такое ПЦР-диагностика, на чем она основана и почему в последнее время ее стали считать самой перспективной технологией в постановке диагнозов, касающихся инфекционных и вирусных заболеваний? Мы расскажем о преимуществах ПЦР-метода, его особенностях и этапах проведения.
ПЦР-диагностика: что это такое?
Диагностика методом ПЦР существует чуть более 30 лет. Значительно эволюционировав за это время, она зарекомендовала себя как один из наиболее точных способов выявления инфекций. В основе метода лежит принцип многократного увеличения микроскопических концентраций фрагментов ДНК возбудителя в биологической пробе пациента в искусственных условиях. В результате сложного процесса, называемого амплификацией, под воздействием ферментов и изменения температуры (от 50 до 95°С) из одной молекулы ДНК образуется две. При этом происходит копирование участка ДНК, который присутствует только у того вида патогенного микроорганизма, который интересует врача.
Цикл образования новой молекулы ДНК занимает всего около 3 минут, а тридцати-сорока циклов вполне достаточно, чтобы получить количество молекул, необходимое для достоверного визуального определения методом электрофореза.
Кроме амплификации, то есть простого увеличения числа копий молекулы ДНК, с помощью ПЦР можно производить и другие манипуляции с генетическим материалом, например, сращивать фрагменты ДНК, вводить мутации и т.д. Это позволяет использовать ПЦР не только для диагностики инфекционных и генетических заболеваний, но и для установления отцовства, клонирования и выделения новых генов.
ПЦР-диагностика проводится в специальных лабораториях с помощью амплификационного оборудования. На сегодня существует множество различных модификаций ПЦР, включая технологии с использованием не только ДНК, но и фрагментов рибонуклеиновой кислоты (РНК). В некоторых из них амплификация осуществляется при постоянной температуре, и для их проведения специальное оборудование не требуется.
Еще одна популярная модификация ПЦР — мультиплексная амплификация (МПА), которая позволяет проводить исследование сразу нескольких изучаемых фрагментов в одной пробирке. Это не только ускоряет и удешевляет проведение анализа, но и позволяет рассматривать одни фрагменты, получившиеся в результате реакции, в качестве положительных маркеров для других, что еще больше увеличивает точность исследования методом ПЦР.
В клинической медицине ПЦР-диагностика является одним из наиболее востребованных методов анализа в самых разных сферах:
- Прямое определение возбудителя инфекции. Некоторые традиционные методы, такие как иммуноферментный анализ (ИФА), выделяют только белки-маркеры, которые являются продуктом жизнедеятельности возбудителей инфекции, а потому только косвенно указывают на присутствие микроорганизмов. Наличие специфического участка в ДНК, выявленное с помощью ПЦР, безошибочно или почти безошибочно указывает на присутствие конкретной инфекции.
- Высокая специфичность метода . Она обусловлена тем, что в исследуемом материале выявляется фрагмент ДНК, характерный только для конкретного возбудителя инфекции. Специфичность исключает возможность ложных результатов анализа, тогда как в иммунологических методах исследований ошибки вполне вероятны из-за перекрестной реакции антигенов.
- Высокая чувствительность . При помощи ПЦР-диагностики можно выявить присутствие в организме даже единичных клеток вирусов или бактерий в тех случаях, когда обычными методами сделать это практически невозможно. ПРЦ определяет наличие всего 10–100 клеток в пробе, тогда как иммунологическими и микроскопическими тестами можно определить наличие инфекции при количестве клеток не менее 103–105.
- Универсальность . Сходство состава всех ДНК или РНК дает возможность применять универсальные методы лабораторных исследований, диагностируя сразу несколько возбудителей из одной биологической пробы.
- Скорость получения результатов . Поскольку для проведения ПЦР-диагностики не нужен посев и выделение культуры возбудителя, то и большого количества времени на нее не требуется. Весь цикл — от забора биоматериала до получения результатов — занимает 4–5 часов.
- Диагностика латентных инфекций . ПЦР-методом диагностируются трудно культивируемые и некультивируемые формы микроорганизмов, встречающиеся в тех случаях, когда заболевание протекает в скрытой форме.
Методом ПЦР можно выявлять возбудителей инфекции не только в организме человека, но и в почве, воде, продуктах питания.
Тем не менее не стоит думать, что ПЦР-диагностика не имеет недостатков. У нее есть свои ограничения, но их количество настолько незначительно, что не может отрицательно повлиять на популярность и эффективность метода:
- Вероятность амплификации ДНК не только живого, но и погибшего микроорганизма . При проведении ПЦР-диагностики для контроля эффективности лечения необходимо соблюдать определенные требования. В частности, проводить ПЦР нужно после определенного промежутка времени (1–2 месяца), за который происходит полное исчезновение возбудителя инфекции в организме.
- Возможность возникновения перекрестной реакции . Подбор фрагментов ДНК (праймеров) осуществляется на основе знаний о генетическом строении конкретного микроорганизма. Но теоретически такой же фрагмент может присутствовать и у других микроорганизмов, геном которых на сегодняшний день еще не расшифрован. Их присутствие в пробе может привести к ложноположительному результату анализа.
- Изменчивость микроорганизмов . Эта способность возбудителей к мутации иногда приводит к тому, что некоторые их штаммы становятся неуловимыми в процессе ПЦР-анализа.
Чтобы уменьшить риски, разработаны стандарты объемов испытаний тест-систем ПЦР-диагностики, включающие проверку на перекрестные реакции и тестирование всех известных штаммов конкретного возбудителя.
ПЦР-диагностика проводится в специальной лаборатории в несколько этапов.
- Забор биоматериала . Процедура, предшествующая непосредственному анализу, которая осуществляется в процедурном кабинете соответствующего профиля. Забор делается с помощью стерильного оборудования только в стерильные пробирки. Материалом для исследования могут быть:
- Эпителиальные соскобы со слизистых оболочек: из уретры, из цервикального канала, со слизистой дыхательных путей и зева, из конъюнктивы. Забор проводится с помощью специального ершика, при этом недопустимо попадание в материал следов крови.
- Моча . Собираются первые 50 г утренней мочи в стерильную емкость. Материал используется для диагностики мочеполовых инфекций.
- Мокрота . Используется для ПЦР-диагностики туберкулеза и респираторных форм микоплазмоза и хламидиоза. Мокроту собирают в стерильный флакон в количестве 15–20 мг.
- Кровь, сыворотка, плазма . С их помощью диагностируются гепатиты, герпес, ВИЧ-инфекция. Для анализа используется венозная кровь (1–1,5 мл), собранная у пациента натощак в стерильную пробирку. Хранить биоматериал можно не более суток при температуре 4°С. Замораживать кровь категорически запрещается.
- Биологические жидкости . К ним относятся слюна, сок простаты, околоплодная, плевральная, спинномозговая, суставная жидкости. Собираются при помощи пункции с использованием стерильного инструментария в количестве 0,1–1,5 мл в стерильные пробирки.
- Биоптаты , т.е. материалы, полученные путем биопсии. Обычно на анализ отправляют биоптаты двенадцатиперстной кишки или желудка, чтобы выявить хеликобактерную инфекцию. Объем материала 2–3 мм 3 .
- Хранение и транспортировка биоматериала . Хранить образцы можно при комнатной температуре не более 2 часов. Если необходимо длительное хранение, то пробы помещают в холодильник с температурой 2–8°С на срок не более одних суток. Допустимо хранение некоторых биоматериалов в течение двух недель в замороженном виде при температуре -20°С. Оттаивание и повторное замораживание проб запрещено. Транспортировка, если она необходима, должна проводиться в специальных термоконтейнерах или термосах с соблюдением всех правил хранения и перевозки биоматериалов.
- Выделение ДНК из образца . Способ выделения зависит от вида определяемого микроорганизма и от вида биологического образца. Если, например, анализируется соскоб эпителиальных клеток, используется так называемый метод твердофазной сорбции, заключающийся в добавлении в образец специального вещества, концентрации ДНК на сорбенте и его многократной отмывке буферным раствором.
- Проведение ПЦР . Некоторое количество образца из биологической пробы переносится в специальную микроцентрифужную пробирку. Туда же добавляется амплификационная смесь, имеющая сложный состав, в объеме 25 мл. Пробирки устанавливают в программируемый термостат, и автоматическом режиме проводится амплификация. Время ее проведения зависит от заданной программы и составляет 2–3 часа. Одновременно с опытными пробами проводятся контрольные — положительные , включающие в себя контрольный препарат ДНК исследуемого возбудителя, и отрицательные , не содержащие исследуемую ДНК. Количество циклов амплификации варьирует от 30 до 40, более 40 циклов проводить не рекомендуется, так как это способствует увеличению количества неспецифических продуктов в пробе.
- Регистрация результатов . Фрагмент ДНК, характерный для возбудителя инфекции, выделяют методом электрофореза в присутствии специального вещества — бромистого этидия. Его соединение с фрагментами ДНК дает светящиеся полосы при облучении ультрафиолетовым излучением. Образец помещают в камеру для электрофореза и в течение 35–40 минут проводят разделение продуктов амплификации. После этого образец просматривают в ультрафиолетовом свете — наличие оранжевой светящейся полосы свидетельствует о положительном результате.
- Интерпретация результатов исследования . Результат ПЦР-диагностики может быть либо положительным, либо отрицательным. Положительный результат говорит о том, что в организме человека обнаружены следы инфекции, причем именно в данный момент времени. Количественный результат ПЦР-анализа оценить может только врач, они индивидуальны для разных типов инфекций. На основании количественного результата можно сделать вывод о степени активности заболевания и определить характер лечения.
Цена ПЦР-диагностики зависит от того, на какую конкретно инфекцию пациент планирует проверяться, от вида анализируемого материала, методики тестирования — качественной или количественной. Цена за определение одной инфекции составляет от 200 до 800 рублей в разных клиниках. Кроме того, к стоимости анализа добавится и плата за забор биоматериала — около 400 рублей. Средняя стоимость ПЦР-диагностики разных видов приведена в таблице 1.
Таблица 1 . Примерные цены на анализы ПЦР в Москве
| Название анализа | Цена, руб. |
| Определение ДНК хламидия | 750 |
| Определение ДНК микоплазмы хоминис | 540 |
| Определение микоплазмы гениталиум | 350 |
| Определение ДНК уреаплазмы | 350 |
| Гонококк, определение ДНК | 350 |
| Определение ДНК герпеса (разные типы) | 350–600 |
| Определение ДНК кандиды | 570 |
| Вирус краснухи, определение РНК | 800 |
| Дифференцированное определение ДНК ВПЧ (разные типы) | 350–1900 [1] |
Читайте также:


