Метод окраски туберкулезных палочек
Возбудитель – микроорганизмы рода mycobacterium (mycos – гриб, bacterium- палочка), включает в себя много видов (49), как патогенных, так и непатогенных. К патогенным относятся микобактерии, вызывающие туберкулез у людей (myc.tuberculosis), животных (myc.bovis), птиц (myc.avium-intracellulare), мышей (myc. мurium).
Наряду с истинными возбудителями от животных и человека, с объектов внешней среды выделяют так называемые атипичные, неклассифицированные, анонимные микобактерии, отличающиеся по своим свойствам от туберкулезных и друг от друга.
Туберкулез – инфекционная, хронически протекающая болезнь человека, животных, в том числе птиц, особенно кур. Патологоанатомически он характеризуется образованием туберкул (бугорков) и творожисто-перерожденных туберкулезных очагов. Возбудителей туберкулеза человека и крупного рогатого скота открыл Р.Кох в 1882 г. Птичий вид установил Штраус и Гамалея (1891).
Морфология. Микобактерии туберкулеза – кислото-, спирто- и щелочеустойчивые микроорганизмы, неподвижны, спор и капсул не образуют, жгутиков не имеют. Их типичная форма – стройные или слегка изогнутые палочки с закругленными краями. В электронном микроскопе микобактерии всех видов имеют вид палочки с закругленными краями. Однако встречаются нередко изогнутые и овальные формы. Размеры клеток одной и той же культуры могут значительно варьировать – длина от 1,5 до 4 мкм, ширина от 0,2 до 0,5 мкм. Особенно это заметно в культурах разных возрастов. Установлена филогенетическая близость туберкулезных микобактерий с лучистыми грибами-актиномицетами. Это сходство проявляется в медленном развитии микобактерии на элективных питательных средах, а также в способе размножения, полиморфности и способности при определенных условиях иногда образовывать нитевидные ветвистые формы с колбовидными вздутиями на концах, что напоминает актиномицеты. Это и явилось причиной замены названия бациллы Коха микобактерией туберкулеза (myc.tuberculosis).
Микобактерии характеризуются высоким содержанием липидов (от 30,6 до 38,9%), вследствие этого медленно воспринимают анилиновые красители. Окрашивание их достигается применением концетрированного карболового фуксина при подогревании. При таком способе окраски микобактерии туберкулеза хорошо удерживают его и не обесцвечиваются при воздействии разведенных кислот, щелочей и спирта, чем они и отличаются от других микробов. На этом основан метод окраски и дифференциации микобактерий по Цилю-Нильсену.
Микобактерии с трудом окрашиваются по Граму и приобретают темно-фиолетовый цвет.
В культурах, выделенных от крупного рогатого скота, чаще находят шаровидные образования правильной формы, одних размеров, а также отдельно лежащие нитевидные структуры.
Культивирование.Микобактерии туберкулеза способны размножаться в строго аэробных условиях на соответствующих элективных питательных средах, содержащих в определенных соединениях углерод, азот, водород и кислород. Из минеральных веществ жизненно необходимыми оказались магний, калий, сера и фосфор. Стимулирующее влияние на рост туберкулезных микобактерий оказывают соли железа и некоторые другие элементы. Для осуществления биохимических процессов у микобактерий необходимым условием является оптимальная температура: 37-38 0 С для человеческого, 38-39 0 С для бычьего и 39-41 0 С для птичьего вида. Следует отметить, что микобактериям туберкулеза присущ медленный обмен веществ, а следовательно они характеризуются замедленным ростом культур на средах. Рост их проявляется через 7-30 дней и более.
При выборе среды следует учитывать ее назначение: для пересева и сохранения субкультур лучше пользоваться простыми глицеринсодержащими средами (МПГБ, глицериновый картофель). Для первичного выделения культур оправдали себя только плотные яичные среды (Петраньяни, Гельберга и др.). Для работы по изучению биохимии микобактерий и других целей целесообразно пользоваться безбелковыми синтетическими средами (Сотона, Моделя).
На плотных средах микобактерии растут в виде колоний, которые могут быть гладкими (S-форма) или бородавчатыми (R-форма), мелкими либо крупными, блестящими или матовыми, в виде изолированных колоний или в виде сплошного налета, в виде белого или белого с желтым оттенком, или же другого цвета.
Биохимические свойства. Микобактерии туберкулеза содержат различные ферменты. Ферменты эстеразы и липазы расщепляют жиры, что дает возможность микобактериям использовать их в качестве питательного материала. Дегидразы расщепляют органические кислоты, в том числе аминокислоты. Уреазы расщепляют мочевину, перигалоза – углеводы, каталаза – перекись водорода.
Протеолитические ферменты (протеазы) расщепляют белок. Микобактерии ферментируют алкоголь, глицерин и многочисленные углеводы, лецитин, фосфатиды. У молодых микобактерий туберкулеза сильно выражены редуцирующие свойства, что, в частности, проявляется в их способности восстанавливать теллурит.
микобактерий туберкулеза обладают значительной устойчивостью к химическим и физическим воздействиям, особенно к высушиванию. В высушенной мокроте, кусочках пораженной ткани, пыли микобактерии жизнестойки от 2 до 7 месяцев и более. В воде микроб выживает 5 мес., в почве – 7 мес., при гниении материала – 76-167 дней и дольше. Холод не влияет на жизнеспособность микобактерий.
Микобактерии весьма чувствительны к воздействию прямых солнечных лучей, в жаркие дни в мокроте они погибают через 1,5-2 ч. Особенно губительны для микобактерии ультрафиолетовые лучи. Большое значение в санитарно-профилактическом отношении имеет высокая чувствительность микобактерии к нагреванию. Во влажной среде микобактерии гибнут при 60 0 С в течение 1 ч, при 65 0 С – через 15 мин, при 70-80 0 С – через 5-10 мин. В свежем молоке возбудитель туберкулеза сохраняется в течение 9-10 дней, в скисшем молоке – гибнет под воздействием молочной кислоты. В масле микобактерии сохраняются неделями, а в некоторых сырах – даже месяцами. микобактерий туберкулеза по сравнению с другими неспорообразующими бактериями значительно более устойчивы к химическим дезинфицирующим веществам, 5%-ный раствор фенола и 10%-ный раствор лизола разрушают возбудителя по истечении 24 ч, 4%-ный формалин – после 12 ч.
Из дезинфицирующих растворов при туберкулезе рекомендуют: 15%-ный раствор смеси, приготовленной из равных частей сернокарболовой кислоты и 16%-ного раствора гидроокиси натрия, время воздействия до 4 ч; 3%-ный щелочной раствор формальдегида при 3-кратном нанесении на объект и 3-часовой экспозиции; хлорную известь в виде порошка, растворов и взвесей, содержащих не менее 5 % активного хлора при экспозиции не менее 3 ч; 3-5%-ный раствор хлорамина Б, гипохлор, 1%-ный раствор глутарового альдегида, 8,5%-ную эмульсию феносмолина из расчета 1л/м 2 и при экспозиции 3 ч и др.
Патогенность.Микобактерии бычьего вида патогенны для многих животных (коровы, овцы, козы, свиньи, лошади, кошки, собаки, олени, маралы и др). Из лабораторных животных наиболее чувствительны кролики и морские свинки, у которых развивается генерализованный туберкулез.
Птичий вид микобактерий вызывает туберкулез у кур, индеек, цесарок, фазанов, павлинов, голубей, уток и др. В естественных условиях птичьими микобактериями заражаются домашние животные (лошади, свиньи, козы, овцы, иногда крупный рогатый скот), а в некоторых случаях и человек.
Инкубационный период длится от нескольких недель до нескольких лет. Доказана персистенция L–форм в организме, которые обладают способностью к реверсии в типичные микобактерии. Наличие L–форм рассматривают как причину рецидива туберкулеза в оздоровленных стадах (В.С.Федосеев, А.Н.Байгазанов, 1987).
Лабораторная диагностика.Выделить возбудителя туберкулеза в чистом виде трудно. Успех во многом зависит от характера исследуемого материала. В качестве последнего можно использовать пораженные органы и ткани, гной, молоко, масло, творог, мочу, фекалии, навоз, почву, воду, соскобы с различных объектов животноводческих помещений и т.п. В каждом случае перед посевом необходимо выбирать соответствующий метод обработки исследуемого материала.
Для освобождения от посторонней микрофлоры исследуемый материал (молоко, мочу, слизь, пораженные органы и ткани) обрабатывают 6-10%-ным раствором серной кислоты (метод Гона). Общее воздействие раствора серной кислоты на материал не должно превышать 25-30 мин.
Для обработки жидкого, полужидкого материала и соскобов с объектов среды обитания животных используют метод флотации. Сущность метода заключается в том, что исследуемый материал взбалтывают в колбе с углеводородами (бензол, бензин и др.) и всплывающий слой пены, то есть флотат, содержащий микобактерии туберкулеза, используют для приготовления мазков, посевов на питательные среды, заражения лабораторных животных.
При убое животных, положительно реагирующих на туберкулин, и отсутствии патологоанатомических изменений в лимфатических узлах, тканях и органах туберкулезного характера, туши выпускают без ограничений, шкуры – без дезинфекции.
Молоко от коров неблагополучных по туберкулезу, обезвреживают в хозяйстве при 90 0 С в течение 5 мин или при 85 0 С в течение 30 мин, после чего отправляют на молокозавод, где его подвергают повторной пастеризации при обычном режиме. Запрещается продажа молока и молочных продуктов на рынке из неблагополучных по туберкулезу хозяйств и от клинически больных и положительно реагирующих на туберкулез животных частного сектора.
Полностью туша и все другие продукты убоя направляются на утилизацию в двух случаях: первый – когда туши имеют тощую упитанность, любую форму поражения туберкулезом органов или лимфатических узлов, второй - при обнаружении генерализованного туберкулезного процесса независимо от упитанности.
Аллергическая диагностика туберкулеза. В практике ведущее значение для прижизненного распознавания туберкулеза у животных и птиц имеет аллергическая диагностика при помощи туберкулина (Р.Кох, 1890). Следует указать, что еще до сообщения Коха в России Гельман в 1888-1889 гг. изготовил экстракт из туберкулезных бактерий и испытал его с диагностической целью на больных туберкулезом коровах, получив при этом положительный результат. Диагностика с помощью туберкулина завоевала прочное положение в медицине и ветеринарии. В настоящее время основным методом проверки животных на туберкулез является внутрикожная туберкулиновая проба. Для изготовления туберкулинов для млекопитающих используют штаммы только одного бычьего вида. Применяют сухой очищенный туберкулин (протеин-пурифиед-дериват – ППД).
Иммунитет и средства специфической профилактики. При туберкулезе он нестерильный, длящийся до тех пор, пока в организме находятся живые микобактерии туберкулеза.
Вакцину против туберкулеза предложили в 1924 г. французские ученые Кальметт и Герен.
В ветеринарной практике вакцину БЦЖ применяют в неблагополучных по туберкулезу хозяйствах в соответствии с наставлением, утвержденным в 1985 г. (М.А.Сафин).
Не нашли то, что искали? Воспользуйтесь поиском:
Общие свойства мокроты и ее микроскопия. До того как мокрота будет исследована на наличие микобактерий, лаборант по ее внешнему виду определяет количество, запах, цвет, консистенцию, характер. Жидкую мокроту, состоящую из гнойных клеток, определяют как гнойную; мокроту с преобладанием гноя или слизи — как гнойно-слизистую или сли-зисто-гнойную; мокроту без гноя, содержащую только слизь, как слизистую, содержащую только кровь,— как кровянистую, а с примесью слизи и гноя — как кровянисто-слизисто-гнойную.
По консистенции мокрота может быть тягучей, студенистой, умеренно вязкой, жидкой.
Далее под микроскопом исследуют нативный препарат мокроты, для чего готовят 2 препарата на одном предметном стекле и накрывают двумя покровными стеклами. Исследование проводят при малом увеличении (объектив 10, окуляр 7) и с объектом 40.
В нативном препарате определяют наличие лейкоцитов, эозинофилов, эритроцитов, клеток эпителия, эластических и других видов волокон и прочих элементов.
Для диагностики туберкулеза большое значение имеет обнаружение в препарате эластических волокон, присутствие которых указывает на разрушение ткани. Эластические волокна в мокроте могут быть и при других заболеваниях (например, при абсцессе легких, новообразованиях, эхинокок-козе и др.). Под микроскопом эластические волокна имеют вид длинных, блестящих волокнистых образований равномерной толщины.
При наличии каверны эластические волокна покрываются мылами и приобретают вид кораллов. Коралловидные волокна образуются при наличии в каверне жира, солей кальция и магния, образующих мыла, которые и покрывают эластические волокна. Если в мокроту добавить 10 % раствор едкой щелочи, то мыла очищаются и выявляются обычные эластические волокна.
Большое диагностическое и прогностическое значение имеет выявление в препарате так называемой тетрады Эрлиха, в которую входят следующие элементы:
- 1) обызвествленные эластические волокна,
- 2) обызвествленные частицы жирового распада,
- 3) кристаллы холестерина,
- 4) измененные микобактерии туберкулеза.
Такие элементы в мокроте наблюдаются при распаде старых обызвествленных очагов.
Методы обнаружения и выделения возбудителя туберкулеза. Наиболее надежным подтверждением диагноза туберкулеза является обнаружение возбудителя в выделениях больного или взятых из организма материалах.
Основным материалом для исследования является мокрота. При отсутствии мокроты исследуют слизь из гортани или промывные воды бронхов, иногда — промывные воды желудка. Исследованию подлежат также моча, кал, спинномозговая жидкость, экссудат из плевральной полости, ас-цитическая жидкость, пунктат из закрытых натечников. При необходимости исследуют кусочки тканей или органов, взятые у больных во время операции. Материал для исследования должен быть взят с соблюдением правил асептики.
Результаты исследований во многом зависят от правильности сбора материала, его обработки и хранения. Важное значение имеет и правильное приготовление мазков или материала для посева на питательные среды.
Для обнаружения МТ в выделениях больного применяют бактериоскопический (микроскопия мазков), бактериологический (посев материала на питательные среды) и биологический (заражение лабораторных животных) методы.
Сбор и подготовка материала для исследования.
Мокрота. Следует собирать утренние порции мокроты и исследовать ее в тот же день. Если у больного мало мокроты, то ее собирают в течение дня (суточная мокрота). Для усиления секреции мокроты применяют раздражающую аэрозольную ингаляцию, для чего используют аэрозольный ингалятор типа АИ-1. Для ингаляции рекомендуется 15 % раствор натрия хлорида в 1 % растворе натрия гидрокарбоната. Ингалируют 30—60 мл раствора, нагретого до 42—45 °С. Индивидуальные мерные стаканчики и мундштуки подлежат дезинфекции. При отсутствии мокроты у больных получают промывные воды бронхов. У детей чаще исследуют промывные воды желудка, так как они плохо откашливают мокроту и заглатывают ее.
Лучше исследование мокроты проводить до начала лечения ежедневно в течение 3 дней подряд. Объяснить больному, что он должен собирать не носоглоточную слизь и слюну, а отделяемое из верхних дыхательных путей при кашле.
Перед сбором мокроты больной должен прополоскать рот и зев кипяченой водой. Мокрота должна быть собрана в стерильную плевательницу. Промывные воды бронхов получает врач-ларинголог. Для микроскопии и посева используют осадок, полученный при центрифугировании промывных вод.
Моча. В мочу могут попасть непатогенные микобактерии смегмы, которые имеют морфологическое сходство с мико-бактериями туберкулеза. Поэтому перед взятием мочи необходим тщательный туалет наружных половых органов. Утреннюю мочу следует брать стерильным катетером в стерильную посуду. Если результат утренней порции мочи отрицателен, то 2—3 дня подряд берут суточную порцию мочи, которую отстаивают в течение ночи, верхний слой сливают, а остаток центрифугируют в течение 30 мин при 3000 об/мин. Осадок используют для приготовления мазка и посева.
Кал. В хлопьях слизи и гноя можно обнаружить микобактерии туберкулеза (методом бактериоскопии и посева).
Спинномозговая жидкость. Ее оставляют на сутки при комнатной температуре. На поверхности жидкости образуется фибринозная пленка, из которой и делают мазок на стекле. При отсутствии пленки жидкость центрифугируют при 2000 об/мин в течение 30 мин, после чего ее сливают, а из осадка делают мазок.
Бактериоскопия (микроскопия) мазков. Микроскопическое исследование мазков является наиболее простым, доступным, дешевым и быстрым методом обнаружения микобактерий. Он остается одним из основных методов исследования.
Недостатком прямой бактериоскопии окрашенных мазков является низкая чувствительность метода. При микроскопии можно обнаружить М'Г в мокроте, если в 1 мл мокроты содержится не менее 10000—100000 палочек. В настоящее время под влиянием химиотерапии количество микробов в мокроте значительно снижается, что создает дополнительные трудности в выявлении возбудителя. В связи с этим в повседневной практике работы широко применяют методы обогащения и накопления микобактерий, которые позволяют концентрировать возбудителей туберкулеза в небольшом объеме материала. Совершенствуются и сами методы бактериоскопии и выделения возбудителя.
Мазки для микроскопии готовят из любого материала, полученного от больного (мокрота, кал, моча, плевральный экссудат, гной, спинномозговая жидкость).
Приготовление мазков из мокроты. Мокроту выливают в чашку Петри, под которую подкладывают лист черной бумаги, на фоне последней хорошо заметны жел-тогнойные комочки, которые и следует отбирать. Гнойные комочки деревянными заостренными палочками переносят на предметное стекло. Мазок готовят путем растирания комочков между 2 стеклами. Затем мазок высушивают на воздухе, фиксируют путем проведения мазка через пламя горелки и окрашивают по Цилю-Нильсену.
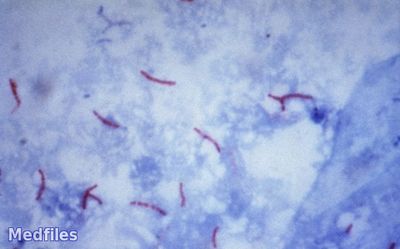
Окраска мазка по Цилю-Нильсену. На мазок наливают основной фуксин Циля и подогревают его до появления пара. После остывания мазка краску сливают и мазок промывают водопроводной водой, обесцвечивают 10—15 % раствором серной кислоты или 3 % раствором солянокислого спирта до появления бледно-розового цвета и после этого снова промывают водой. Затем мазок докрашивают 0,5 % раствором метиленового синего в течение 1/2 мин. Мазок промывают водой и высушивают.
На мазок наносят каплю кедрового масла и микроско-пируют. Микобактерии под микроскопом окрашены в рубиново-красный цвет в виде тонких прямых или слегка изогнутых палочек и располагаются единично или небольшими группами на сине-голубом фоне, в который окрашены вещество мокроты и различные клетки. При лечении химиопрепаратами микобактерии часто приобретают вид толстых и грубых палочек, похожих на кокки, и имеют более светлую окраску.
Бактериоскопия дает приблизительно на 10 % больше положительных результатов при использовании метода флотации, позволяющего в 5—10 раз увеличить концентрацию микобактерий.
Метод флотации заключается в том, что бензин, бензол, ксилол, толуол и другие углеводороды легче воды, добавленные в мокроту с водой, при встряхивании разбиваются на мельчайшие капельки, которые, поднимаясь кверху, адсорбируют на себе микобактерии.
В банку объемом 250 мл со стеклянными бусами вносят 10—15 мл мокроты (или другого исследуемого материала — кал, осадок мочи, экссудата и др.), добавляют примерно равное количество 0,5—1 % раствора едкого натра и встряхивают до полного разжижения мокроты. Затем добавляют 100 мл дистиллированной воды и 0,5—1 мл любого углеводорода и встряхивают в течение 5—10 мин. После этого в бутылку добавляют дистиллированной воды до горлышка и оставляют при комнатной температуре на 30—60 мин. На поверхности появляется беловатое пенистое флотационное кольцо, которое отсасывают пастеровской пипеткой с резиновым баллончиком и наносят на предметное стекло. По мере подсыхания капли на нее наносится новая порция. Наслаивание после подсыхания проводится 4—5 раз. После этого мазок фиксируют и окрашивают по Цилю-Нильсену.
Для концентрации возбудителя широко применяют также метод седиментации (осаждения). К мокроте прибавляют равный объем 10 % раствора натрия фосфата, который является хорошим гомогенизатором мокроты, не нарушает жизнедеятельность микобактерий и в то же время угнетает рост сопутствующей микрофлоры. После добавления натрия фосфата смесь инкубируют при температуре 37 °С в течение 24 ч, затем центрифугируют 5—10 мин при 2000 об/мин. Надосадочную жидкость потом сливают, а осадок используют как для посева, так и для микроскопии.
Более чувствительной является люминесцентная микроскопия, которая на 20—30 % по сравнению с обычной увеличивает положительный результат. Этот метод основан на способности липидов микобактерий воспринимать люминесцентные краски, которые светятся при облучении их короткими синими или ультрафиолетовыми лучами. Светящиеся микобактерии хорошо видны. Мазок можно просматривать при малом увеличении гораздо быстрее, чем при объективе с иммерсией. Мазок готовят как обычно, фиксируют смесью Никифорова и пропитывают специальными красителями (флюорохромами): аурамином в разведении 1:1000 или родамином С. Затем мазок обесцвечивают солянокислым спиртом и докрашивают кислым фуксином. Под микроскопом микобактерии светятся на темном фоне ярким золотисто-зеленым цветом. Микроскопию проводят в люминесцентном микроскопе или на обычном с опакиллюминатором (насадкой), пропускающим короткие синие и ультрафиолетовые лучи.
Недостаток метода микроскопии состоит в том, что он не позволяет безусловно дифференцировать патогенные и непатогенные микобактерии. С целью ориентировочной дифференциации патогенных и непатогенных микобактерий при микроскопии используют более длительное обесцвечивание мазков кислотой или спиртом. Сапрофиты после этого частично или полностью обесцвечиваются, а патогенные микобактерии удерживают окраску.
В последние годы появилась возможность отличать в мазках живые и мертвые микобактерии, что может служить дополнительным важным критерием оценки эффективности лечения. Суть метода состоит в том, что дезоксирибонуклеи-новая кислота (ДНК) живых микобактерий воспринимает окраску метиленовым зеленым, а у мертвых ДНК этой окраской не окрашивается. В то же время ДНК мертвых микобактерий может окрашиваться дополнительными красителями: пиронином, сафронином или карболовым фуксином.
Наиболее надежным, достоверным и чувствительным методом диагностики туберкулеза является метод выделения чистой культуры микобактерий (бактериологический). Этот метод позволяет выявить микобактерии при содержании 20—100 возбудителей в исследуемом материале, увеличивает положительный результат на 15—30 %. Выделенную культуру можно изучить, дифференцировать от непатогенных микобактерий, определить ее вирулентность и устойчивость возбудителя к лечебным препаратам. Недостатками бактериологического метода являются сложность обработки материала и длительный рост возбудителя на средах.
Засеваемый материал гомогенизируют и одновременно обрабатывают серной или соляной 6 % кислотой или 4—6 % раствором едкого натра для уничтожения посторонней микрофлоры. Осадок после центрифугирования служит материалом для посева. Посев производят на яичную среду Левенштейна-Йенсена, которая рекомендована Всемирной организацией здравоохранения в качестве стандартной среды. Посев материала делают в 5 пробирок. При обработке материала серной кислотой вся процедура подготовки для посева должна быть выполнена быстро — в пределах 15 мин, так как более длительная экспозиция в кислоте снижает способность микобактерий к росту. Микобактерии вырастают на среде на 15—25-й день после посева. Жидкие материалы (моча, ликвор, экссудат, промывные воды желудка и бронхов) перед посевом необходимо центрифугировать и для устранения посторонней микрофлоры обработать осадок 3 % раствором серной кислоты в течение 20 мин. После этого обработанный кислотой материал повторно центрифугируют, а осадок используют для посева на среду. Ликвор, полученный стерильно, засевают без обработки кислотой.
Можно делать также посев мазка из гортани. Мазок берут ватным тампоном с надгортанника под контролем гортанного зеркала. Тампон помещают в небольшой объем 3—5 % раствора серной кислоты, отжимают его, а раствор центрифугируют. Осадок засевают на среду.
Иногда пользуются ускоренными методами посевов, из которых наиболее известен метод Прайса. Этот метод состоит в том, что подсушенный мазок мокроты после обработки его в серной кислоте и промывания погружают в пробирки с кровяной средой на 7—10 дней. Затем мазок промывают, сушат, фиксируют и окрашивают по Цилю-Нильсену. Применение для обработки мокроты поверхностно-активных веществ (лаурилсульфат; лауросепт и др.) значительно увеличивает рост микобактерий.
Для посева патологического материала используют плотные, полужидкие и жидкие питательные среды, но ни одна из них не обладает всеми необходимыми качествами. Поэтому посев делают на 2—3 различные среды. Чистые культуры выделяют на плотных, полужидких яичных и агаровых средах.
В настоящее время обязательно определение устойчивости микобактерий к стрептомицину, тубазиду и ПАСКу (парааминосалициловая кислота). С этой целью готовят набор сред Левенштейна с тремя разными концентрациями каждого препарата. Микобактерии, которые растут при концентрации 10 мкг/мл и более стрептомицина и ПАСКа и при концентрации 1 мкг/мл и более тубазида, считаются лекарственно-устойчивыми.
Большое значение в микробиологической диагностике туберкулеза имеет определение количества микобактерий в исследуемом материале для оценки тяжести процесса, тактики лечения и его эффективности.
Биологический метод исследования основан на заражении патологическим материалом морских свинок, которые очень чувствительны к туберкулезной инфекции. Этот метод признается более чувствительным для обнаружения микобактерий. Появление измененных под влиянием химиотерапии микобактерий иногда дает отрицательные результаты заражения животных при положительных результатах посева на среды. Это происходит в результате значительного снижения или полной утраты микобактериями вирулентности. С целью повышения количества положительных результатов морским свинкам перед заражением ежедневно вводят большие дозы кортизона, снижающего их резистентность. Через 3—4 нед после введения исследуемого материала морской свинке ставят туберкулиновую пробу. Положительная реакция будет свидетельствовать о присутствии микобактерий туберкулеза. Если животное не погибает через 3 мес, его забивают и различные ткани подвергают микроскопическому исследованию. Для целей диагностики этот метод в настоящее время имеет ограниченное применение, поскольку посев на питательные среды дает достаточно хорошие результаты.
Туберкулез (от лат. tuberculum – бугорок) – это инфекционное антропозоонозное заболевание, вызываемое микобактериями и характеризующееся развитием специфического гранулематозного воспаления, чаще хроническим течением, многообразием клинических проявлений и поражением различных органов, главным образом дыхательной системы.
1. Туберкулез – это самая распространенная инфекция.
3. В России один из самых высоких уровень заболеваемости туберкулезом.
4. Туберкулез – это инфекция, которая чаще всего является причиной смерти и инвалидности.
5. Туберкулез может поражать любой орган и систему организма, поэтому врач любой специальности должен знать и уметь распознать туберкулез.
Причины распространенности туберкулеза:
Проблема туберкулеза – на 80% социальная проблема и лишь на 15% зависит от состояния здравоохранения.
1. Снижение социально-экономического уровня жизни граждан.
2. Сокращение объемов финансирования противотуберкулезных программ, дефицит противотуберкулезных препаратов, дорогостоящее лечение.
3. Распространение лекарственно устойчивых штаммов микобактерий туберкулеза.
4. Распространение ВИЧ-ассоциированного туберкулеза (на сегодняшний день в РФ зарегистрировано более 13 тыс. случаев ВИЧ-ассоциированного туберкулеза).
5. Недостатки в работе первичного звена по диагностике и раннему выявлению туберкулеза.
Семейство – Mycobacteriaceae (от греч. myces – гриб, bacteria – палочка).
Виды – M. tuberculosis (92%), M. bovis (5%), M. africanum (3%).
Морфология и тинкториальные свойства.
Характерен полиморфизм и склонность к ветвлению:
· в свежих культурах – прямые или слегка изогнутые палочки размером 0,3-0,6×1-4 мкм;
- зернистые формы (зерна Муха – от 2 до 12 зерен разной величины, не являются КУБ);
Из зерен, фильтрующихся и L-форм могут восстанавливаться в обычные формы, что способствует поддержанию хронического воспаления, возникновению рецидивов.
Жгутики отсутствуют, спор не образуют, имеют микрокапсулу, кислото-спирто-щелочеустойчивые (клеточная стенка на 46% состоит из липидов в 3-х фракциях: фосфатиды, воски и жирные кислоты – туберкулостеариновая, фтионовая, миколовая и др.).
Грамположительны. Окрашиваются по методу Циля-Нильсена в красный цвет, зернистые формы – в фиолетовый. При окраске ауромином приобретают желтый цвет.
Строгие аэробы (M. bovis – микроаэрофилы), оптимальная температура 370С, рН 6,4-7,2, большое содержание липидов замедляет обмен веществ, поэтому видимый рост M. tuberculosis появляется через 12-25 дней, M. bovis – через 21-60 дней, M. africanum – через 31-42 дня (это обусловлено длительным периодом генерации клеток – 14-15, даже до 24 часов, тогда как у большинства бактерий – 20-30 минут). Рост стимулируется 5-10% СО2, 0,5% глицерина и лецитином. Культивируются только на сложных питательных средах с глицерином, витаминами группы В, аминокислотами и глюкозой, а для подавления токсического действия жирных кислот добавляют активированный уголь, сыворотку животных и альбумин, а для подавления роста сопутствующей флоры – красители (малахитовый зеленый).
* среда Левенштайна-Йенсена (яично-картофельная среда с добавлением глицерина и малахитовой зелени для подавления сопутствующей флоры);
* среда Петраньяни (яично-картофельная среда с добавлением глицерина, кусочков картофеля и молока);
* среды Финна 2 (яичная среда), Миддлбрука и др.
* среда Сотона (аспарагин, глицерин, цитрат Fe и фосфат К);
* Миддлбрука, Дюбо, Школьниковой и др.
В жидких средах видимый рост появляется на 5-7 день в виде тонкой нежной желтоватой пленки, которая постепенно утолщается, становится морщинистой, ломкой, раствор остается прозрачным.
Относительно активны. M. tuberculosis обладает каталазной активностью (в отличие от каталазы условно-патогенных микобактерий термолабильна), уреазой, никотинаминидазой, восстанавливает нитраты, накапливает в среде ниацин (ниациновый тест Конно – среда желтеет под действием никотиновой кислоты).
M. bovis и M. africanum обладают только уреазой, не восстанавливает нитраты, не продуцирует никотинаминидазу и не накапливает в среде ниацин, т.к. превращает его в ниацинрибонуклеотид.
Антигены туберкулезной палочки – это полисахаридные (родоспецифические антигены), белковые (туберкулопротеины), липидные компоненты клетки, фосфатиды. Туберкулопротеиды
являются полными антигенами, полисахариды только в соединении с γ-глобулинами. Антигены стимулируют образование антиполисахаридных, антифосфатидных, антипротеиновых и иных антител различной специфичности (но протективной роли не играют). Также антигены индуцируют развитие ГНТ и ГЗТ.
Экзотоксины не вырабатывают.
Токсическими свойствами обладают химические компоненты клетки:
- Корд-фактор (высокотоксичен) – оказывает токсическое действие на ткани, блокирует окислительное фосфорилирование на митохондриях, тем самым нарушая функцию дыхания, защищает от фагоцитоза, подавляет миграцию лейкоцитов.
- Липиды (миколовая, фтионовая и туберкулостеариновая кислоты, фосфатидный фактор, мураминдипептид, воск Д) и полисахариды – стимулируют развитие специфического гранулематозного воспаления в тканях (образование эпителиоидных клеток, гигантских многоядерных клеток Пирогова-Лангханса).
- Туберкулопротеин – индуцирует развитие ГЗТ.
Ферменты патогенности: лецитиназа, каталаза, пероксидаза.
Среди неспорообразующих бактерий самые устойчивые к действию неблагоприятных факторов окружающей среды. Устойчивы к кислотам, щелочам, спиртам, высушиванию (в высохшей мокроте до 2 месяцев). Рассеянный солнечный свет инактивирует микобактерий в течение 1-1,5 месяцев, прямой – 1,5 часа. На белье, книгах – свыше 3 месяцев; в воде – более 1 года; в почве – до 2 лет; в уличной грязи – до 4 месяцев; в желудочном соке – 6 месяцев; в масле – 10 месяцев. Выдерживают температуру жидкого азота (-1900С), при кипячении погибает через 5-7 минут, 500С – 12 часов, в молоке при 90-950С – 5 минут. 5% карболовая кислота, 1:1000 сулема – 1 сутки, 10% формалин – 12 часов, 5% фенол – 6 часов, 0,05% бензилхлорфенол – 15 минут. Чувствительны к УФО (погибают через 2-3 минуты) и хлорсодержащим дезсредствам (3-5 часов). Губительно действуют стрептомицин, рифампицин, тубазид, фтивазид, ПАСК.
Источник инфекции – больной человек и животные.
- Аэрогенный (пути – воздушно-капельный, воздушно-пылевой);
- Фекально-оральный (путь – алиментарный);
- Контактный (путь – непрямой контактный);
- Вертикальный (путь – трансплацентарный, реализуется редко, т.к. микобактерии вызывают развитие тромбоза кровеносных сосудов плаценты).
Инкубационный период – 3-8 недель – 1 год (до 40 лет).
Патогенез и клинические особенности.
К 40 годам 70-90% людей инфицированы, но только у 10% развивается первичный туберкулез.
В 85-95% случаях заболевание начинается в легких и во внутригрудных лимфатических узлах. Остальные случаи – это туберкулез костей, суставов, кишечника, мочеполовой системы и т.д.
При попадании в альвеолы M. tuberculosis вызывает образование первичного аффекта – специфической гранулемы (бугорка, от лат. granulum – зернышко, греч. oma – окончание опухолей): в центре его располагается зона казеозного некроза с M. tuberculosis, окруженная зоной эпителиоидных и гигантских многоядерных клеток Пирогова-Лангханса, далее расположен вал из лимфоцитов и мононуклеарных фагоцитов.
Из гранулемы M. tuberculosis, поглощенные макрофагами (незавершенный фагоцитоз), по лимфотическим сосудам (лимфангоит) проникает в регионарные лимфоузлы (лимфаденит). Т.о. формируется первичный туберкулезный комплекс, состоящий из:
- лимфаденит.
При высокой естественной резистентности первичный очаг окружается соединительнотканной капсулой и обызвестляется – формируется очаг Гона (петрификат). Микобактерии в виде L-форм могут сохранять жизнеспособность в первичном очаге многие годы.
При снижении невосприимчивости развивается прогрессия, которая может осуществляться 4 путями – развивается диссеминированный туберкулез:
2. Гематогенный путь.
3. Рост первичного аффекта вплоть до казеозной пневмонии.
4. Смешанный путь.
В ряде случаев первичный туберкулез может принимать хроническое течение в виде туберкулезной интоксикации, лихорадки и т.д.
Вторичный туберкулез развивается при повторном массивном инфицировании микобактериями, либо эндогенным путем из очага Гона и других локализаций первичного туберкулеза.
Симптомов, характерных только для туберкулеза, нет.
Значительный естественный иммунитет.
Приобретенный иммунитет – ведущее место клеточный нестерильный (устойчивость к суперинфекции). Формируется ГЗТ.
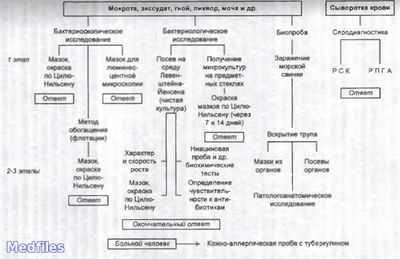
Исследуемый материал – мокрота, гной, моча, СМЖ, плевральная жидкость, промывные воды желудка, кусочки органов, кровь.
1. Бактериоскопический метод.
2. Бактериологичекий метод (основной).
3. Ускоренный метод Прайса на обнаружение корд-фактора.
4. Биологический метод.
5. Серологический метод – РИФ, РСК, РПГА, РДП в геле, ИФА, РИА, иммуноблотинг.
6. Молекулярно-биологический метод – ПЦР, ДНК-гибридизация.
7. Аллергологический метод – проба Манту с 2 ТЕ PPD-L.
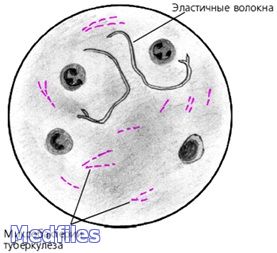
Обнаружение микобактерий туберкулёза при бактериоскопическом методе диагностики (схематично).
В исследуемом материале обнаруживают микобактерии туберкулеза путем микроскопии мазков, окрашенных по Цилю-Нильсену и с применением люминесцентных красителей (чаще всего аурамина). Бактериоскопию рассматривают как ориентировочный метод. Бактериологический метод является основным в лабораторной диагностике туберкулеза.
Посевы делают на среду Левенштейна-Йенсена и инкубируют при 37°С в термостате в течение 3 мес. Выделенные культуры идентифицируют и определяют их чувствительность к химиотерапевтическим препаратам. Для ускоренного обнаружения микобактерий делают посевы по методу Прайса, позволяющего получить микрокультуры туберкулезных бактерий и определить наличие корд-фактора, когда микобактерии располагаются в форме кос и жгутов.
В некоторых случаях, например, при туберкулезе почек, прибегают к биологической пробе -заражению морских свинок с последующим выделением чистой культуры. Кожно-аллергические туберкулиновые пробы (реакция Манту) ставят с целью выявления лиц, инфицированных туберкулезными микобактериями, для оценки течения туберкулезного процесса у больных, а также для контроля эффективности вакцинации и отбора лиц для ревакцинации BCG .
В последние годы большое внимание уделяется новым методам диагностики туберкулеза — цепной полимеразной реакции (ЦПР) и др
Оценка пробы Манту с 2 ТЕ (через 48-72 часа).
- Отрицательная – уколочная реакция (несостоятельность поствакцинального иммунитета, иммунодифицитные состояния).
- Сомнительная – инфильтрат 2-4 мм/только гиперемия любого размера.
- Положительная – инфильтрат 5 мм и более.
- Гиперэргическая – инфильтрат 21 мм и более/везикуло-некротическая реакция независимо от размера инфильтрата.
У здорового вакцинированного человека проба Манту в норме должна быть слабоположительной (папула – 5-12 мм).
Плановая вакцинация в соответствии с национальным календарем прививок в возрасте 3-7 дней жизни живой аттенуированной туберкулезной вакциной БЦЖ (BCG – Bacille Calmette Guerin) – авирулентный штамм M. bovis (длительно культивируют на картофильно-глицериновом агаре с бычьей желчью).
Первая ревакцинация – в 7 лет при отрицательной пробе Манту.
Вторая ревакцинация – в 14 лет при отрицательной пробе Манту и не получившим прививку в 7 лет.
Специфическое лечение – не разработано.
Неспецифическое лечение – АБ, ХТП: изониазид (тубазид), ПАСК, рифампицин, стрептомицин, этамбутол и др.
Читайте также:


