Как проводится забор крови на малярию



Выписка из Методических указаний по забору и исследованию крови на малярию
Подтвердить диагноз малярии можно только исследовав кровь под микроско-
пом .Кровь для исследования берут при первом же подрзрении на малярию вне
зависимости от наличия или отсутствия лихорадки в этот момент.
Кровь на малярию исследуют методом толстой капли и тонкого мазка.
основной метод исследования –изучение толстой капли.
Процедура исследования крови с целью обнаружения малярийных
паразитов включает три этапа:
1.приготовление препаратов крови.
Толстая капля и тонкий мазок должны быть приготовлены на обезжиренных предметных стеклах с неповрежденной поверхностью.
Подготовка предметных стекол
Предметные стекла ,не бывшие в употреблении, подвергают предстерилизационной обработке согласно ОСТ42-21-2-85 от 10.07.85.г. после чего помещают в сосуд с
водопроводной водой , которую меняют 6-7 раз, затем прополасктвают дистилли-
рованной водой ,вытирают чистой хлопчатобумажной тканью и помещают в смесь
Никифорова ( для приготовления смеси Никифорова берут равные количества этилового
спирта-ректификата эфира из расчета 1мл.спирта на одно стекло) Через сутки обезжиренные стекла извлечь из спирто-эфирной смеси,высушить хлопчатобумажной тканью, завернуть в чистую бумагу не более 10 штук в упаковке и подвергнуть стерилиззации в сухожа-
ровом шкафу при 180 – 1час. Стекла, бывшие в употреблении,требуют более тщательной обработки. Если на стеклах имеется иммерсионное масло, его следует удалить
бензолом или другим растворителем жира (ксилол, толуол), вату и ветошь, применяемые
для снятия иммерсионного масла, подвергают обеззараживанию с последующей утилизацией. Стекла замачивают в 3% растворе хлорамина на 60 минут или любом другом
дезинфектанте. Дальнейшая предстерилизационная обработка и стерилизация сходны
с обработкой и стерилизацией стекол, не бывших в употреблении.
Во время всех манипуляций с предметными стеклами их нужно брать так, чтобы
Не касаться пальцами поверхности стекла.
При работе с препаратами крови медработник должен соблюдать правила по про-
филактике профессионального заражения:
· работать в резиновых перчатках;
· не допускать приема пищи и курения в помещенях для проведения забора корви
· иметь в наличии антисептики
· поверхности рабочих столов и использованные емкости в конце рабочего дня или в случае загрязнения кровью обеззараживать 3% раствором хлорамина.
Приготовление препарата крови.
Приготовление препаратов крови складывается из следующих зтапов:
· распределение крови по стеклу;
Очистка кожи
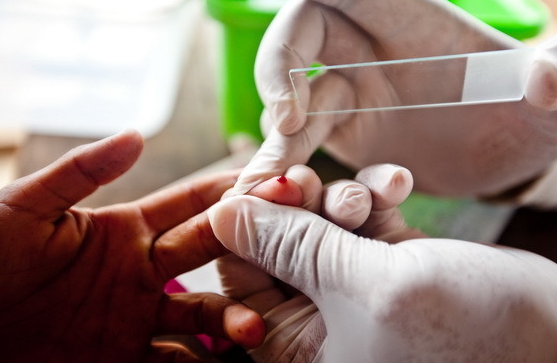
Обычно кровь берут из третьего или четвертого пальца левой руки (можно брать из мочки уха, а у грудных
детей – из большого пальца ноги или пятки ). Очень важно , чтобы кожа в месте прокола была чистоой , так
как попавшие в препарат микроорганизмы могут привести к диагностическим ошибкам .Грязные руки моют мылом. Кожу в месте укола тщательно протирают 70% этиловым спиртом. Первую каплю крови ,
выделившуюся после прокола , удаляют стерильной ватой . При этом удаляют остатки алкоголя , которые
могут способствовать фиксации крови в препарате.
Необходимо пользоваться иглами –копьями разового пользования.
Стерильные иглы-копья берутся стерильным пинцетом. В процессе работы не должна допускаться
расстерилизация пинцета, нельзя выкладвать пинцет на нестерильную поверхность стола. Для этого
используют стерильную прбирку или стерилизатор, в которых пинцет стерилизовался. Вата должна стерилизоваться в виде отдельных шариков , помещенных в пакет из крафтбумаги. Должна быть поставлена дата стерилизации. Нельзя допускать расстерилизацию ваты путем перекладывания из пакета в нестерильную емкость.
При заборе крови укладка должна быть условно разделена на чистую половину, где установлены емкости
со стерильными материалами, инструментами, и грязную половину (отработанные копья,стекла с мазками,
На стерильном материале и инструментарии должна быть указана дата стерилизации, наименование
инструментария и количество
Приготовление тонкого мазка
На предметное стекло с правой стороны, отступив от края на 1-1,5 см наносят маленькую капельку
крови.Стекло кладут на горизонтальную поверхность и фиксируют его левой рукой. В правую руку
берут шлифованное стекло , опускают его в каплю крови таким образом , чтобы кровь распределилась
ровной полоской между краем шлифованного стекла и поверхностью предметного. Затем легким
равномерным движением вдоль стекла распределяют кровь по предметному стеклу. Правильно
сделанный мазок должен быть равномерно тонким с бахромкой на конце , через него можно
прочитать печатный текст.
При приготовлении мазка большое значение имеет угол наклона шлифованного стекла.
Нормальной толщины мазок получается при наклоне стекла под углом 30-35. Если угол наклона
больше 45, мазок будет коротким и толстым. Если шлифованное стекло наклонить до 20-25, то получится
очень длинный мазок до самого края предметного стекла. Исследование таких мазков затруднено.
Тонкий мазок высыхает очень быстро. После высыхания его маркируют, с этой целью лучше использовать
ПРИГОТОВЛЕНИЕ ТОЛСТОЙ КАПЛИ
Исследуемая толстая капля должна быть определенной величины.Она должна быть не слишком толстой,
но и не слишком тонкой. Диаметр толстой капли должен быть около 20мм. Рекомендуется делать две
капли на одном стекле на случай , если одна из них окажется испорченной . Существует несколько
способов приготовления толстой капли .
1. К выступившей из прокола капле крови диаметром 3-4мм прикасаются предметным стеклом,
избегая касания поверхности кожи, и распределяют кровь по стеклу в кружок одним движением.
2. На предметном стекле сначала готовят мазок немного толще обычного, затем, пока он еще не высох,
на него наносят две капли крови, которые по влажному мазку растекаются правильными дисками.
Второй способ является наилучшим для приготовления толстой капли. Необходимо соблюдать
правила высушивания толстых капель: высыхать они должны постепенно, их нужно держать
вдали от нагревательных приборов или прямых солнечных лучей .
Недопустимо делать надписи на поверхности толстой капли. Для маркировки нужно провести дополнительную полоску кровью , расположив ее между толстыми каплями или ближе к концу
стекла .Капли, приготовленные на мазке, маркируют, используя свободную поверхность мазка.
маркировку делают простым карандашом после высушивания препарата . Неокрашенные толстые
капли не подлежат длительному хранению.
На препаратах крови указывать фамилию обследуемого, как было указано выше (между толстыми
каплями на штрихе крови и на тонком мазке простым карандашом).
Направление для исследования крови на малярию
15 марта 2017, 10:47 Эксперт статьи: Блинова Дарья Дмитриевна 0 7,941
Малярия — одно из опаснейших паразитарных заболеваний на планете, ежегодно поражающее сотни миллионов человек. Люди должны понимать, как проводятся исследования на малярию, как распознать симптомы и когда обратиться за лечением. Ежегодно из сотен миллионов заразившихся сотни тысяч умирают, несмотря на то, что существует лекарство, заболевание поддается лечению.
Что такое малярия?
Малярия — опасное и очень заразное паразитарное заболевание, легко передающееся через укусы комаров рода анофелис и через кровь, например, при переливании. Недуг сопровождается повторяющимися приступами лихорадки, наиболее широко распространен в странах с влажным и жарким климатом. После того как паразит попал в тело, он начинает размножаться, поражает клетки, разрушает их, лавинообразно наращивая свое присутствие. Посему решившие посетить жаркие тропические страны должны проявлять повышенную осторожность, и при наименьших подозрениях сдать анализ крови. Заражению особенно подвержены:
- люди с низким иммунитетом,
- дети до 5 лет,
- беременные женщины.
Виды плазмодий
Всего различают четыре различных вида малярии и четыре типа плазмодий, ее вызывающие:
- Plasmodium falciparum, что провоцирует тропическую лихорадку — одну из самих опасных и нуждающихся в срочном лечении разновидностей заболевания.
- Plasmodium vivax — провоцирует появление трехдневной малярии.
- Plasmodium malariae — является источником четырехдневной лихорадки.
- Plasmodium ovale — главная причина малярии овале (недуга вроде трехдневной).
Симптомы малярии
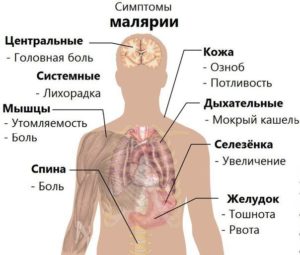
Главными (и самим очевидными) симптомами, проявляющимся при малярии, являются повторяющиеся с равными промежутками времени приступы лихорадки, повышение температуры и озноб. Длятся они несколько часов и сопровождаются такими признаками:
- повышение температуры до 41 °C;
- дрожь;
- проявления кашля;
- повышенная потливость (обычно сопровождает окончание приступа и снижение температуры).
Кроме того приступы могут сопровождаться такими явлениями как:
- расстройства пищеварительной системы,
- боль в разных частях тела, мышцах, голове,
- повышенная утомляемость,
- желтуха.
Хотя обычно симптомы при малярии проявляются спустя несколько недель после заражения, некоторые возбудители могут месяцами жить в организме незаметно. Во время острых приступов наблюдается тенденция к изменению состава крови, может возникать анемия, в особенности при тропической лихорадке. Возможно увеличение внутренних органов, например селезенки, но точную оценку может дать лишь врач.
Диагностические исследования малярии
При обнаружении вышеперечисленных симптомов необходимо срочно провести диагностику малярии. Единственным основным способом диагностирования заболевания до сих пор остается непосредственное обнаружение плазмодиев в крови, которая берется у больного во время приступов. Самые распространенные способы анализа включают взятие крови на малярию методом толстой капли и мазка. Обнаружив плазмодии, можно определить, серьезно ли болен человек, каким именно штаммом. Проводятся также общее исследование крови, обследование мочи, биохимические исследования на содержание билирубина или уровень альбумина.
Поскольку паразит влияет непосредственно на кровь, из-за лихорадки в ее составе наблюдаются различные изменения. Таким образом, показано проведение общего обследования крови для выявления малярии. Лейкоцитоз, анемия, тромбоцитопения — вот лишь немногие возможные последствия болезни.
В общий анализ входят:
- Сравнение уровня гемоглобина, а также эритроцитов — плазмодии влияют напрямую на кровяные тельца, разрушая их во время болезни.
- Оценка показания уменьшения тромбоцитов — наблюдается у подавляющего большинства больных, является одним их характерных признаков малярии.
- Проверка лимфоцитов — их уровень тоже может меняться во время болезни.
Можно также выделить ряд других анализов крови, что могут обнаружить малярию:
- Метод выявления антител к малярии — позволяет с помощью введения в организм плазмодия отслеживать реакцию иммунитета на него. Если итогом будет негативная реакция, это позволит исключить диагноз.
- Метод выявления белков плазмодия является одним из новейших возможных анализов, позволяющих определять составные молекулы возбудителя. При сравнительной быстроте способ обладает неплохой точностью, а также небольшими финансовыми затратами для пациента.
- Метод ПЦР, или полимеразная цепная реакция — непосредственно определяет генетический материал малярийного плазмодия. Проводя такой анализ крови можно определить точное число возбудителей, даже если оно небольшое. К сожалению, одним из недостатков является высокая стоимость процедуры.
Анализ мазка и толстой капли крови являются наиболее дешевыми и простыми методами обнаружения малярии. В то же время они требуют внимательности и значительных трудозатрат, а также исполнения ряда рекомендаций. При необходимости обследовать более одного пациента необходимо подготовить инструментарий заранее. При тонком мазке кровь берут из безымянного либо среднего пальца на левой руке. При изготовлении мазка палец удерживается ранкой кверху. Мазок крови — небольшой, его располагают в центре стекла.
Толстая капля отличается от мазка возможностью исследовать больший объем материала. Если обычные мазки крови— тоненькие, то капля, наносимая на стекло этим методом, имеет размер с монету. В итоге, исследуется в десятки раз больший объем крови. В дальнейшем каплю подсушивают, и после окрашивания краской Романовского, промывания — исследуют. Лучше, если анализы будет проводить опытный исследователь, ведь неподготовленный может принять за паразитов различные загрязнения или образования: бляшки Биццоцеро, обломки лейкоцитов, различные микроорганизмы, включая грибок или простейших, случайно попавших на образец.
Цель:диагностическая.
Ресурсы:70% спирт, предметные стекла, обезжиренные смесью Никифорова, бланки направлений, ручку, стеклограф, спички, круглую резинку, конверт из крафт бумаги, лоток для сброса, емкость с дезраствором. Стерильные: лоток, индивидуальные перья-копья, ватные шарики.
Алгоритм действия:
1. Установить доверительные отношения с пациентом.
2. Объяснить цель и ход процедуры.
3. Вымыть и просушить руки.
4. Надеть перчатки и маску.
5. Обработать кожу 4-го пальца руки спиртом.
6. Проколоть последнюю фалангу 4-го пальца индивидуальным пером-копьем.
7. Поместить перо в лоток для сброса.
8. Снять первую каплю крови сухим ватным шариком.
9. Поместить ватный шарик в емкость с дезраствором.
10. Повернуть палец проколом вниз.
11. Прикоснуться предметным стеклом ко второй капле крови, отступив от узкого края стекла на 1,5-2 см.
12. Приложить ватный шарик к месту прокола.
13. Поставить шлифованное стекло перед каплей крови под углом 45 0 .
14. Продвинуть шлифованное стекло до соприкосновения с каплей крови правой руки.
15. Сделать мазок быстрым движением, когда кровь равномерно распределится между обоими стеклами.
16. Указать регистрационный номер с обратной стороны стекла.
17. Высушить препарат в воздухе в горизонтальном положении.
18. Поместить толстую каплю между двумя стеклами, используя спички и круглую резинку.
19. Оформить направление в паразитологическую лабораторию.
20. Поместить препарат в конверт и отправить немедленно в лабораторию.
Первый тип или полный противочумный костюмсостоит из: пижамы или комбинезона, большой косынки (капюшона), противочумного халата, ватно-марлевой маски, очков-консервов, резиновых перчаток, носков (чулок), сапог резиновых, полотенца.
Цель:противочумный костюм первого типа применяется при:
Алгоритм действия:
- работе в госпитале, провизорном госпитале и др. с больными легочной или септическими формами чумы.
- до установления окончательного диагноза у больных бубонной и кожной формами чумы и до получения отрицательного результата бактериологического исследования;
- больных КВЛ (геморрагическими вирусными лихорадками);
- работе в изоляторе для контактных с больными легочной формой чумы и больных КВЛ;
- проведении текущей и заключительной дезинфекции (дезинсекции и дератизации) в очаге заболеваний легочной формой чумы;
- вскрытии трупа погибшего от чумы;
- проведении подворных обходов;
- заборе материала для лабораторных исследований от больных с подозрением на чуму, КГВЛ.
Примечание: Для вскрытия трупа необходимо дополнительно иметь вторую пару перчаток, клеенчатый фартук, нарукавники.
Названия:
Второй тип противочумного костюма состоит: из пижамы или комбинезона, большой косынки (капюшона), противочумного халата, ватно-марлевой маски, резиновыфх перчаток, носков (чулок), резиновых сапог, полотенца.
Цель:противочумный костюм второго типа применяется при:
Алгоритм действия:
- работе в госпитале, провизорном госпитале и др. с больными оспой обезьян;
Цель:Купирование острых нарушений функций кровообращения и дыхания: блокирование поступления лекарства-аллергена в кровоток: подержание жизненно важных функций организма.
Ресурсы: тонометр, фонендоскоп, стерильные: одноразовые шприцы, ватные шарики, спирт этиловый 70%, резиновый жгут, перчатки, пинцет в дезрастворе, лоток, лекарственные препараты: адреналин 0,1%- 0.5 мл, физиологический раствор 200 мл, преднизолон 30-60мг, 10-15мл. 5% р-ра глюкозы, супрастин 1% 2-4 мл или димедрол 1% 2-5мл. эуфиллин 2,4%-10мл, строфантин 0,05%-0,5мл.
Алгоритм действий:
1. Прекратить введение аллергена, наложить жгут выше места инъекции:
2. Уложить пациента и зафиксировать язык, голову на бок, удалить зубные протезы.
3. Приподнять ножной конец кровати:
4. Обеспечить доступ свежего воздуха, подать увлажненный кислород:
5. При пероральном приеме лекарства-аллергена промыть больному желудок, если позволяет его состояние.
6. Контролируйте пульс, дыхание, артериальное давление.
7. Ввести адреналин 0,1%- 0.5 мл с 5 мл физ. раствора в/в или п/к 0.5-1 мл в месте введения аллергена.
8. Ввести преднизолон 30-60мг, 10-15мл. 5% раствора глюкозы в/в медленно.
9. Ввести супрастин 1% 2-4 мл или димедрол 1% 2-5мл.
10. Ввести эуфиллин 2,4%-10мл в 10 мл физ.раствора в/в при затруднении дыхания.
11. Ввести строфантин 0,05%-0,5мл на 10 мл физ.раствора в/в по показанием.
12. Следить за состоянием пациента: измерять пульс, АД.
1. Уложите пациента в постель.
2. Расстегните стесняющую одежду.
3. Обеспечьте доступ свежего воздуха.
4. Измерьте температуру :
А.Если температура тела 37,0-37,5ºС назначьте обильное питание:
В. Если температура тела 37,5-38,0ºС , разденьте и проведите физическое охлаждение: разведите спирт 1:1, протрите и укройте, на лоб приложите холодный компресс, если температура тела 38,0-38,5ºС и выше дайте жаропонижающие препараты: панадол, парацетамол, ибупрофен и т.д.
5. В течение 20-30 минут от начала проведения мероприятия постарайтесь вызвать мочеиспускание ребенка.
6. Измерьте температуру тела через 20-30 минут.
7. Проведите коррекцию проводимых мероприятий с учетом показателей повторной термометрии.
2. проведении текущей и заключительной дезинфекции в очаге бубонной формой чумы, холеры, оспы обезьян;
3. вскрытие трупа погибшей от холеры, оспы обезьяны;
4. заборе материала от больных с подозрением на оспу обезьян.
Третий тип противочумного костюма состоит из: пижамы, противочумного халата, большой косынки, резиновых перчаток, носков, глубоких калош и полотенца.
Цель:противочумный костюм третьего типа применяется при работе в госпитале, провизорном госпитале с больными бубонной или кожной формой чумы, получающими специфическое лечение.
Противочумный костюм четвертого типа состоит из: пижамы, медицинского халата, шапочки или марлевой косынки, носков, тапочек (туфель).
Цель:противочумный костюм четвертого типа применяется при:
Алгоритм действия:
- работе в госпитале, провизорном госпитале с больными холерой. При проведении туалета больного, надевают резиновые перчатки, при обработке выделений – маску;
- заборе материала для лабораторных исследований от больных с подозрением на холеру (дополнительно надевают резиновые перчатки).
ОБРАБОТКА НА ПЕДИКУЛЁЗ
ЦЕЛЬ: выявление вшей, гнид и их ликвидация.
ОСНАЩЕНИЕ:
1. Укладка по Ф. № 20.
8. Журнал регистрации выявленных случаев педикулёза.
9. Ёмкости с дезинфицирующими растворами.
ПОДГОТОВКА ПАЦИЕНТА И МЕДИЦИНСКОГО РАБОТНИКА:
1. Сообщить пациенту цель и ход процедуры.
2. Надеть халат, перчатки, косынку (убрать все волосы), фартук.
3. Пригласить пациента.
ПОМНИ! Обработка пациента производится или в боксе приёмного покоя (при поступлении), или в специальной комнате (если пациент находится в отделении).
ТЕХНИКА ВЫПОЛНЕНИЯ:
1. На пол около ванны (раковины) постелить клеёнку.
2. На клеёнку поставить стул с моющимся сидением.
3. Усадить пациента.
4. Покрыть плечи пелериной, заправив её за одежду.
5. По возможности обрезать волосы ножницами (с согласия пациента). При необходимости у мужчин сбрить бороду, усы, брови (одноразовым инструментарием).
7. По истечении экспозиции: снять косынку и вымыть голову с мылом.
8. Осушить волосы полотенцем.
9. Взять расчёску с мелкими зубцами, проложить зубцы ватой, смоченной в 4% уксусной кислоте (уксус помогает отклеиванию гнид).
10. Поэтапно расчёсывать волосы по прядям, по мере загрязнения вату на расчёске менять.
11. Высушить волосы и повторно осмотреть.
12. Снять пелерину и поблагодарить пациента.
ЗАВЕРШЕНИЕ:
1. Полотенце, косынку замочить в растворе: хлорамина: 3% - 30 минут (1% - 60 минут; анолита 0,03% - 60 минут). Затем ополоснуть и выстирать.
2. Стул обработать двукратным протиранием: 3% раствором хлорамина, 0,05% раствором анолита. С интервалом – 15 минут.
4. Клеёнку и пелерину (если клеёнчатая) погрузить в раствор: хлорамина: 3% - на 60 минут (1% - на 120 минут; 0,03% анолита - на 60 минут; 0,4% септодор – форте - на 60 минут). Затем ополоснуть и высушить.
5. Ножницы, машинку для стрижки волос, расчёску обработать обжиганием над пламенем спиртовки.
6. Одноразовый бритвенный станок погрузить в 5% раствор хлорамина на 60 минут, затем упаковать в полиэтиленовый пакет и утилизировать.
7. Медицинский персонал: снять косынку, фартук и замочить в 3% растворе хлорамина, затем ополоснуть и высушить.
8. Снять перчатки, погрузить в 5% раствор хлорамина на 60 минут, затем утилизировать.
9. Вымыть полы с: 3% хлорамином, 0, 03% анолитом, 0,4% септодором с добавлением хлорофоса
10. Заполнить журнал регистрации выявленных случаев педикулёза.
ТЕХНИКА ВЗЯТИЯ МАЗКОВ ИЗ НОСОГЛОТКИ НА МЕНИНГОКОКК
ЦЕЛЬ: собрать материал для бактериологического исследования, провести лабораторную диагностику менингококковой инфекции.
ОСНАЩЕНИЕ:
1. Стерильная пробирка с петлей и ватными тампонами в штативе,
2. Чашка Петри с сывороточным агаром,
3. Маска и стерильные перчатки,
4. Стерильный шпатель,
5. Бланк направления,
ПОДГОТОВКА ПАЦИЕНТА:
1. Объяснить пациенту или родственникам цель и ход процедуры,* получить согласие на проведение процедуры;
2. Сообщить время и место проведения процедуры
ПОДГОТОВКА МЕДИЦИНСКОГО РАБОТНИКА:
1. Выписать направление в лабораторию;
2. Подписать стеклографом пробирку и чашку Петри (со стороны среды);
3. Вымыть и осушить руки;
4. Надеть перчатки и маску;
ТЕХНИКА ВЫПОЛНЕНИЯ:
1. Усадите пациента рядом с источником света и попросите запрокинуть голову несколько назад.
2. Извлеките петлю с ватным тампоном из пробирки на 2/3, взяв её правой рукой за пробку, в которую он вмонтирован,
3. При этом согните её о внутренний край пробирки под углом 135 0 и извлеките полностью.
4. Попросите пациента открыть рот или откройте его сами, для этого заведите шпатель левой рукой за коренные зубы и слегка надавите на него.
5. Зафиксируйте шпателем корень языка, правой рукой петлю со стерильным тампоном введите в полость рта по шпателю изогнутым концом вверх.
6. Осторожно, не касаясь тампоном слизистой оболочки рта и языка, проведите тампон в носоглотку за язычок.
7. Двумя – тремя легкими движениями соберите слизь с задней стенки глотки.
8. Осторожно извлеките петлю с тампоном (не касаясь языка, зубов и неба) и поместите её в пробирку.**
9. Поблагодарите пациента.
ЗАВЕРШЕНИЕ:
1. Вымыть и обработать антисептическим раствором руки в перчатках;
2. Снять маску, перчатки и поместить их в 5% раствор хлорамина на 1 час, затем утилизировать;
3. Вымыть и осушить руки;
4. Отправить собранный материал в бактериологическую лабораторию.
Примечания:*Забор материала производится натощак, до орошения или полоскания рта;
**При посеве на чашку Петри: взять чашку в ладонь, большим, указательным и средним пальцами приоткрыть крышку и посеять материал втирающими движениями.
ВЗЯТИЕ КРОВИ И ПРИГОТОВЛЕНИЕ ТОНКОГО МАЗКА ПРИ МАЛЯРИИ.
ЦЕЛЬ: обнаружение малярийного плазмодиума в крови
ОСНАЩЕНИЕ:
1. 70% раствор спирта этилового и эфира медицинского.
2. Предметные стёкла, обезжиренные смесью Никифорова.
3. Бланки направлений, авторучка, простой карандаш
5. Круглая резинка.
6. Конверт из крафт-бумаги.
7. Лоток для сброса.
8. Ёмкости с дезинфицирующим раствором.
9. Стерильные: лоток, индивидуальные перья-копья, пинцет, ватные шарики.
ПОДГОТОВКА ПАЦИЕНТА И МЕДИЦИНСКОГО РАБОТНИКА:
1. Установить доверительные отношения с пациентом.
2. Объяснить цель и ход процедуры, получить его согласие.
ТЕХНИКА ВЫПОЛНЕНИЯ:
1. Вымыть и осушить руки.
2. Надеть перчатки и маску.
3. Обработать кожу IV пальца руки спиртом.
4. Вскрыть перо – копье, проверив срок годности.
5. Проколоть мякоть латеральной фаланги IV пальца индивидуальным пером-копьём.
6. Поместить перо в лоток для сброса.
7. Снять первую каплю крови сухим ватным шариком.
8. Повернуть палец проколом вверх.
9. Прикоснуться предметным стеклом ко второй капле крови, отступив от узкого края стекла на 1,5-2 см.
10. Приложить ватный шарик к месту прокола.
11. Поставить шлифованное стекло перед каплей крови под углом 45 0 .
12. Продвинуть шлифованное стекло до соприкосновения с каплей крови правой рукой.
13. Сделать мазок быстрым движением, когда кровь равномерно распределится между обоими стёклами.
14. Указать фамилию пациента карандашом на мазке или регистрационный номер с обратной стороны стекла.
15. Высушить препарат на воздухе в горизонтальном положении.
16. Поместить стекло с мазоком между двумя стёклами с помощью спичек и круглой резинки.
17. Поместить препарат в конверт.
ЗАВЕРШЕНИЕ:
1. Оформить направление в паразитологическую лабораторию.
2. Отправить конверт в лабораторию сразу же.
3. Провести дезинфекцию использованного инструментария и оснащения:
· Перо- копьё замочить в 5% растворе хлорамина на 60 минут в, затем утилизировать.
· Тампон и марлевую салфетку замочить в 5% растворе хлорамина на 60 минут, а затем утилизировать.
· Лоток обработать двукратным протиранием 3% хлорамином с интервалом 15 минут или погрузить в раствор на час.
· Снять перчатки, опустить в 5% раствор хлорамина на 1 час, затем утилизировать.
5. Вымыть и осушить руки.
Не нашли то, что искали? Воспользуйтесь поиском:
3.2. ПРОФИЛАКТИКА ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ
Паразитологическая диагностика малярии
Дата введения 2001-01-01
1. Методические указания подготовлены сотрудниками Института медицинской паразитологии и тропической медицины им. Е.И.Марциновского Московской медицинской Академии им. И.М.Сеченова Минздрава России (к.м.н. Рабинович С.А., к.б.н. Кукина И.В., Mа. ская* Е.В., к.м.н. Морозов Е.Н.) и Федерального центра государственного санитарно-эпидемиологического надзора Минздрава России (к.б.н. Цыбина Т.Н., Сыскова Т.Г.).
________________
* Брак оригинала. - Примечание изготовителя базы данных.
2. УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 19 октября 2000 г.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения и нормативные ссылки
1. Область применения и нормативные ссылки
Паразитологическую лабораторную диагностику малярии проводят клинико-диагностические лаборатории лечебно-профилактических учреждений (ЛПУ) системы Минздрава, ведомственных учреждений, а также другие лаборатории, независимо от принадлежности и форм собственности (НИИ, вузов, Минобороны, УВД, частных клиник и т.д.), имеющие лицензию и аккредитованные в системе госстандарта и госсанэпиднадзора в установленном порядке.
Органы и учреждения государственной санитарно-эпидемиологической службы Российской Федерации организуют и проводят эпидемиологический надзор за малярией, частью которого является:
контроль за уровнем лабораторной диагностики малярии в клинико-диагностических лабораториях лечебно-профилактических учреждений и других ведомств (в т.ч. исследования: 1) контрольные - не менее 10% препаратов крови, от числа отрицательных; 2) обязательные - 100% сомнительных и положительных препаратов крови с целью подтверждения лабораторного диагноза малярии);
обследование населения в очагах малярии, обследование населения по эпидпоказаниям и с консультативной целью.
В настоящих методических указаниях использованы ссылки на следующие нормативно-методические и правовые документы.
Федеральный закон "О санитарно-эпидемиологическом благополучии населения" (30 марта 1999, N 52-ФЗ).
"Основы законодательства Российской Федерации об охране здоровья граждан" (22 июля 1993, N 5487-1).
Санитарные правила и нормы 3.2.569-96* "Профилактика паразитарных болезней на территории Российской Федерации".
_______________
* Действуют СанПиН 3.2.1333-03. - Примечание изготовителя базы данных.
Санитарные правила 3.1/3.2.558-96* "Общие требования по профилактике инфекционных и паразитарных заболеваний".
_______________
* Действуют СП 3.1/3.2.1379-03. - Примечание изготовителя базы данных.
Санитарные правила 1.2.731-99 "Безопасность работы с микроорганизмами 3-4 групп патогенности и гельминтами".
2. Общие положения
Возможность завоза малярии на территорию Российской Федерации, появление вторичных от завозных и местных случаев заболевания требуют своевременной лабораторной диагностики, необходимой для адекватного лечения и рационального проведения противоэпидемических мероприятий.
Малярию человека вызывают 4 вида паразитических простейших рода Plasmodium: Р. falciparum - возбудитель тропической малярии, Р. vivax - трехдневной малярии, Р. ovale - малярии типа трехдневной, Р. malariae - четырехдневной малярии. Неспецифические клинические проявления малярии, преимущественно в первые дни болезни, при наличии ряда объективных показателей эпидемиологического характера: географический анамнез (пребывание на территории стран с тропическим и субтропическим климатом) и клинического характера: лихорадочное состояние неясной этиологии, анемия, увеличение селезенки и ряд других - обязывают врачей лечебно-профилактических учреждений заподозрить малярию.
Безусловным подтверждением диагноза служит обнаружение малярийного паразита при микроскопическом исследовании крови. Особое значение имеет раннее выявление возбудителя тропической малярии, при несвоевременной диагностике которой возможен летальный исход. Определение вида паразита служит основанием для выбора рациональной терапии и правильной организации противоэпидемических мероприятий.
3. Характеристика развития малярийного паразита в эритроцитах
Проявления малярии обусловлены развитием паразита в эритроците - так называемой эритроцитарной шизогонией. В процессе эритроцитарной шизогонии образуются бесполые и половые формы паразита.
Бесполые формы за период времени, характерный для каждого вида паразита, проходят в эритроцитах ряд последовательных возрастных стадий своего развития, строение которых (морфология) и их окрашиваемость (тинкториальные свойства) хорошо различимы в "тонком мазке" крови. Трофозоиты - одноядерные растущие стадии: кольцевидные, развивающиеся (амебовидные, полувзрослые) и зрелые. Шизонты - делящиеся стадии: развивающиеся (незрелые), с последовательным делением ядер и общей цитоплазмой и зрелые, представляющие скопление дочерних клеток мерозоитов с обособленными ядрами и цитоплазмой. В динамике эритроцитарная шизогония в общем виде протекает следующим образом. Мерозоит, внедрившийся в эритроцит, быстро увеличивается в размере, в цитоплазме появляется пищеварительная вакуоль и образуется - кольцевидный трофозоит. На этой стадии цитоплазма имеет вид узкого ободка, огибающего пищеварительную вакуоль, ядро сравнительно мелкое, компактное с трудно различимой структурой хроматина, оттеснено к одному из полюсов клетки. По мере роста паразита увеличиваются его размеры, количество цитоплазмы нарастает: ядро становится более крупным, менее компактным. В цитоплазме могут появиться асимметричные утолщения, различающиеся по форме и числу, псевдоподии - образуется амебовидный трофозоит. В дальнейшем у развивающегося трофозоита постепенно исчезает вакуоль, продолжает увеличиваться ядро и количество цитоплазмы - образуется зрелый трофозоит. Зрелый трофозоит - округлая или несколько вытянутая клетка с относительно рыхлым ядром, правильной или несколько вытянутой формы, занимающая весь или часть пораженного эритроцита. Затем наступает стадия шизонта, начинается попарное деление ядер, образуется развивающийся (незрелый) шизонт. По окончании деления ядер одномоментно делится цитоплазма, обособляясь вокруг каждого из дочерних ядер - образуется зрелый шизонт, состоящий из мерозоитов; их число, размеры и расположение по отношению к скоплению пигмента характерны для каждого вида плазмодиев (см. таблицы). При отсутствии или неэффективном лечении мерозоиты внедряются в интактные эритроциты, и цикл вновь повторяется с присущей для каждого вида плазмодиев продолжительностью развития одной генерации. У Р. falciparum, P. vivax, P. ovale - 48 ч, Р. malariae - 72 ч.
В процессе роста паразита в его цитоплазме появляется малярийный пигмент - продукт метаболизма гемоглобина, представляющий собой включения от едва заметных мелких зерен и гранул до относительно более крупных, неправильной формы, от золотисто-коричневого до черного цвета. Количество пигмента, размеры его частиц и распределение в цитоплазме паразита меняются по мере его перехода в последовательные стадии развития.
У части трофозоитов деления ядер не происходит и они дифференцируются в половые формы, гаметоциты - женские (макрогаметоциты) и мужские (микрогаметоциты). Мужские и женские гаметоциты различаются между собой по морфологии, в первую очередь по структуре ядра, характеру и окраске цитоплазмы. В отличие от бесполых форм гаметоциты не имеют выраженной вакуоли, характеризуются значительно более обильным и грубым пигментом. Округлая форма присуща гаметоцитам Р. vivax, Р. ovale и Р. malariae, удлиненная серповидная (полулуния) - Р. falciparum. Гаметоцитов образуется меньше, чем бесполых форм. При этом женских гаметоцитов в 3-5 раз больше, чем мужских, что затрудняет выявление последних. Гаметоциты Р. vivax, Р. ovale, P. malariae значительно отличаются от гаметоцитов Р. falciparum по срокам созревания, появления в периферической крови и сохранения способности заражать переносчика (самок комара Р. anopheles).
Р. vivax, Р. ovale и Р. malariae развиваются в эритроцитах, циркулирующих в периферической крови. Развитие Р. falciparum происходит в синусах селезенки и мелких капиллярах внутренних органов в связи с адгезией пораженных эритроцитов к стенкам таких капилляров. В периферической крови обнаруживаются, преимущественно при неосложненном течении, только самые молодые стадии - кольцевидные трофозоиты. Их число очень быстро нарастает, поэтому при однократном исследовании периферической крови в начале болезни можно получить неправильное представление об истинном числе паразитов. При осложненном течении в периферической крови могут быть обнаружены более зрелые возрастные стадии паразита и гаметоциты в связи с нарушением сосудистого тонуса.
При оценке результатов исследования препаратов крови, наряду с типичной морфологией возбудителя, необходимо учитывать ряд особенностей, характеризующих паразитологическое развитие инфекции собственно и привходящих воздействий (предшествовавшее применение противомалярийных препаратов, неправильное приготовление и окраска препаратов крови).
4. Принцип метода паразитологической диагностики малярии
Паразитологическая диагностика малярии основана на обнаружении бесполых и половых форм возбудителя при микроскопическом исследовании крови, что возможно только в период его развития в эритроците. Для обнаружения плазмодиев и определения их вида используют препараты крови, приготовленные методом "тонкого мазка" и "толстой капли", окрашенные по Романовскому-Гимза. Оба метода, имеющие свои преимущества и недостатки, являются взаимодополняющими.
Основной метод - "толстая капля". Благодаря распределению относительно большего объема крови на меньшей площади, за один и тот же промежуток времени просматривается количество крови в 30-40 раз большее, чем в "тонком мазке", что значительно повышает шанс обнаружения паразитов, особенно при низкой паразитемии. Начинать надо всегда с просмотра "толстой капли".
Чувствительность метода "толстой капли" такова, что при просмотре 100-150 полей зрения можно обнаружить около 8 паразитов в 1 мкл крови. Концентрация исследуемой крови на ограниченной площади приводит к многослойному расположению эритроцитов. Для того чтобы паразиты были видимы, "толстую каплю" окрашивают нефиксированной; это приводит к гемолизу эритроцитов, и паразиты подвергаются деформации. Несмотря на определенную специфичность, такая деформация иногда может препятствовать идентификации вида паразита. Ограничиться просмотром "толстой капли" можно только, если вид паразита был первоначально установлен. "Толстая капля" относительно быстро позволяет выявить и других паразитов крови: трипаносом, микрофилярий, спирохет, бабезий и др. Отрицательный паразитологический результат изучения "толстой капли", но повышенное содержание остатков незрелых эритроцитов позволяет предположить перенесенную недавно малярию (при отсутствии соответствующих анамнестических данных), обнаружение повышенного содержания лейкоцитов, их видовой состав, а также повышенное содержание остатков незрелых эритроцитов, позволяют предположить иное заболевание, не связанное с малярией.
В "тонком мазке", фиксированном до окраски, сохраняются морфологические особенности как пораженного эритроцита, так и присущие данному виду паразита. Большое значение для дифференциального диагноза имеет характер изменения пораженных эритроцитов. "Тонкий мазок" крови делают в дополнение к "толстой капле". В тех случаях, когда вид возбудителя в очаге установлен, для эпиднадзора за очагом можно ограничиться методом "толстой капли".
5. Необходимые реактивы и оборудование
1. Этиловый спирт 96°.
2. Азур-эозин по Романовскому-Гимза (промышленный маточный раствор или сухая краска).
3. Метиленовый синий.
4. Этиловый эфир.
6. Тетраборат натрия (бура).
7. Калий фосфат однозамещенный безводный - KH PO .
Читайте также:


