Иммуноглобулины при хроническом токсоплазмозе
Токсоплазмоз является паразитарной инфекцией, возбудитель – Toxoplasma gondii. Заболевание сопровождается нарушением деятельности центральной нервной системы, патологическим увеличением печени, лимфоузлов и селезенки. Патология не представляет серьезной опасности для человека. Люди болеют, но даже не догадываются об этом. Однако на фоне резкого понижения иммунитета активность паразитов приводит к осложнениям. В группы риска попадают беременные женщины и дети. Анализ на токсоплазмоз подразумевает проведение серологических реакций разными методами. Рассмотрим, как сдавать кровь на токсоплазмоз, какие показатели говорят о норме.
Основные методы диагностики токсоплазмоза

Паразитарное заболевание диагностируется с учетом клинических проявлений и результатов лабораторных и инструментальных методов исследования. За основу берутся серологические реакции.
К сведению, диагностика носит дифференциальный характер. Токсоплазмоз нужно отличить от ряда болезней – мононуклеоз, туберкулез, хламидиоз, герпес и др. бактериальные, вирусные и паразитарные инфекции.
Серологический метод предстает наиболее информативным способом диагностики инфекционных и воспалительных процессов в организме человека. Для исследования берут анализ крови, затем из биологической жидкости получают сыворотку – жидкую часть крови.
В диагностике паразитов используют такие серологические реакции:
- ИФА, РИФ.
- Реакция связывания комплемента. Когда связываются антитела и антигены, то наблюдается прикрепление специфических белковых компонентов, что в свою очередь провоцирует образование иммунного комплекса. Если антитела и антигены не связались друг с другом, то комплемент к ним прикрепиться не может, это говорит об отсутствии комплекса. При токсоплазмозе исследование даст положительный результат.
- Метод Себина-Фельдмана. Суть этой методики заключается в том, что в норме содержимое живых клеток окрашивается в синие цвета. Если же в сыворотке биологической жидкости присутствуют антитела, окрашивание не наблюдается.
Анализ на токсоплазмоз может проводиться посредством аллергического метода. Больному вводят возбудителей внутрикожно. В области введения препарата могут выявляться покраснения и инфильтраты. В зависимости от размера кожного проявления говорят о наличии или отсутствии токсоплазмоза.

Итак, на токсоплазмоз как сдавать кровь, где это можно сделать? Кровь сдают в поликлинике по направлению лечащего доктора либо в частной лаборатории. Исследование требует определенной подготовки. Сдают на голодный желудок, можно пить только воду, но кушать категорически запрещено. За сутки нельзя употреблять алкогольные напитки. Если пациент принимает какие-либо лекарства, то прежде чем сдать анализ крови на токсоплазмоз, необходимо поставить в известность медицинского специалиста.
Исследование иммуноферментным способом на токсоплазмоз – это лабораторная диагностика высокой степени восприимчивости. В ходе обследования обнаруживают антитела, которые называют иммуноглобулинами.
Важно: иммуноферментный анализ крови на токсоплазмоз позволяет выявить антитела класса IgM, IgG, IgA либо антигены определенных инфекционных заболеваний. В результатах указывают не только существование антител, но и их уровень в сыворотке крови.
Для постановки диагноза наиболее важными являются иммуноглобулины IgM, IgG. Они дают информацию не только о наличии паразитарной болезни, но и показывают ее давность:
- Этот иммуноглобулин начинает продуцироваться сразу после инфицирования человека. На 2-3 день его можно обнаружить в биологической жидкости. Если расшифровать анализ на токсоплазмоз, то максимальная концентрация иммуноглобулина наблюдается на 4 неделе болезни;
- IgM выявляется в сывороточной жидкости сразу после заражения, но с течением времени имеет свойство нивелироваться. Если его нашли, то это говорит об остром периоде патологического процесса.
Расшифровка анализа крови должна проводиться медицинским специалистом, поскольку учитывают не только уровень иммуноглобулинов и их наличие, но и авидность к токсоплазмозу.

Часто применяют способ полимеразной цепной реакции (метод ПЦР) на токсоплазмоз, поскольку это особо информативный вариант диагностики. Благодаря методике можно точно выявить ДНК возбудителя в крови. Для проведения исследования используют любой биологический материал – моча, кровь, мокрота, кал, околоплодные воды (при беременности).
В большинстве клинических картин советуется исследовать урину либо кровь. Полимеразная цепная реакция имеет определенные достоинства и минусы. К преимуществам относят точность, низкую вероятность ложноположительного либо ложноотрицательного результата.
Недостатком является относительно высокая стоимость. Помимо этого, такая диагностика требует только качественного оборудования, которое имеется не в каждом медицинском учреждении.
Факт: в большинстве случаев ПЦР – это дополнительный способ диагностики, когда уже была проведена расшифровка анализа на токсоплазмоз методом ИФА и требуется подтвердить либо опровергнуть имеющуюся информацию.
Расшифровка результатов на токсоплазмоз методом полимеразной цепной реакции бывает положительной (+) либо отрицательной (-). В первом случае говорят об инвазии, во втором варианте – о ее отсутствии. Преимущество методики состоит в том, что она выявляет даже ничтожно малое количество паразитирующих микроорганизмов.
Оценка авидности антител

На токсоплазмоз анализ крови предоставляет результаты не только наличия либо отсутствия иммуноглобулинов, но и цифру авидности. Что это такое? Авидность обозначает, что в сданном образце биологической жидкости присутствуют антитела, которые имеют определенное сходство с токсоплазмой.
Чем выше авидность к тосоплазме, тем более специфические иммуноглобулины синтезируются иммунной системой человека. Можно провести сравнение, где антитела это ключ, а антигены являются замком. Так вот, чем больше процент авидности, тем лучше ключик подходит к замку.
В свою очередь, это свидетельствует о том, что иммунитет имел достаточный период времени, чтобы выработать специфические антитела. Анализ на токсоплазмоз характеризуется тремя видами авидности:
- Если показатель меньше 40%, это говорит о малой авидности. Иными словами, молекулы не созрели – после первого контакта с паразитом прошел относительно небольшой период времени. Как правило, в этом случае подозревают острый инфекционный процесс на ранней стадии развития.
- Когда показатель варьируется от 41 до 59% включительно, то говорят о переходной стадии либо серой зоне. Нельзя в полной мере утверждать, что токсоплазмы присутствуют в организме, но и нельзя сказать обратное. Чтобы уточнить предварительный диагноз, проводится еще одно исследование спустя 1-2 недели.
- Более 60% — высокая авидность результатов. Иными словами, иммунитет получил достаточно времени, чтобы ознакомиться с возбудителем патологического процесса, соответственно, успел выработать специфические антитела, ориентированные на его уничтожение.
Стоит знать: авидность свыше 60% — это хроническое носительство либо перенесенное заболевание ранее, что подразумевает стойкий иммунитет. Данный вариант наиболее приемлем в плане прогноза беременности у женщин.
Расшифровка анализов на токсоплазмоз
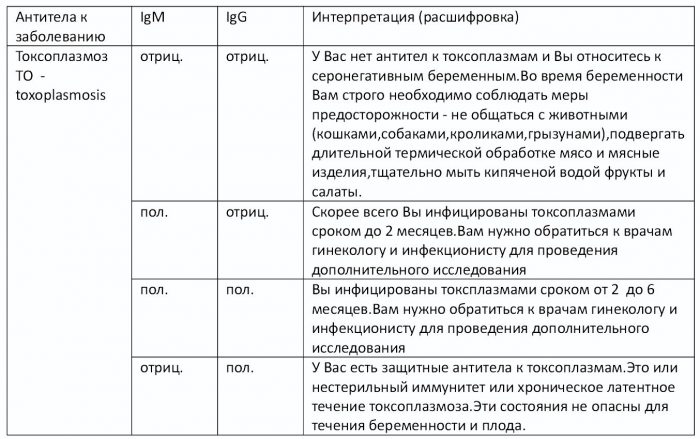
Итак, какая норма анализа на токсоплазмоз? Постановка диагноза зависит от выявления иммуноглобулинов различного класса. IgG относят к значениям хронической патологии, IgM свидетельствует об острой фазе.
Результаты анализов в норме, когда IgM (-), а IgG (+). Такие показатели диагностируются примерно у 65% населения. Если женщина беременна и были получены такие параметры, то обязательно рекомендуется дополнительное проведение полимеразной цепной реакции, поскольку метод более чувствителен даже к мизерному количеству ДНК возбудителей.
- IgM (-) на фоне IgG (-). Такой результат – человек никогда не болел этой инфекцией, следовательно, стойкого иммунитета к ней нет. Женщина во время беременности с такими показателями попадает в категорию риска. Нужно сдавать кровь каждый триместр, чтобы исключить вероятное заражение и последующие осложнения;
- IgM (+) на фоне IgG (+). Трактовать можно по-разному. Человек болеет в данный момент, либо организм справился с инфекцией, но прошло очень мало времени. IgM с плюсом обычно после выздоровления выявляется еще несколько месяцев, иногда и вовсе в течение одного года. Чтобы уточнить результаты требуется проведение ПЦР, установление процентной авидности;
- IgM (+) на фоне IgG (-) – острый инфекционный процесс. Если пациентка беременна, то высока вероятность внутриутробного заражения. Требуется проведение дополнительной диагностики. При положительном повторном результате назначается медикаментозное лечение.
При выявлении острой фазы токсоплазмоза необходимо провести инструментальную диагностику, поскольку болезнь поражает внутренние органы и системы. Рекомендуется проведение УЗИ органов брюшной полости, для исследования сердечно-сосудистой системы – электрокардиограмма, рентген легких.
Лабораторные исследования – это не окончательный диагноз. Несмотря на высокую достоверность описанных методов, нельзя исключать ложноположительный либо ложноотрицательный результат. Прежде чем поставить диагноз, нужно учесть и др. моменты – жалобы пациента, анамнез, результаты дополнительных медицинских манипуляций.
| Маркер | Результат | Трактовка |
| IgG IgM | отрицателен отрицателен | Токсоплазменная инфекция отсутствует, токсоплазмоза нет |
| IgG IgM | отрицателен положителен | Первичная токсоплазменная инфекция |
| IgG IgM | положителен положителен | Острый первичный токсоплазмоз или реактивация латентной инфекции |
| IgG IgM | положителен отрицателен | Токсоплазменная инфекция в фазе латенции или возможен глазной токсоплазмоз |
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПРИОБРЕТЕННОГО ТОКСОПЛАЗМОЗА
Необходимо проводить дифференциальную диагностику с другими инфекционными заболеваниями, которые могут также протекать в генерализованной форме (сепсис, герпетическая инфекция, листериоз, цитомегаловирусная инфекция, инфекционный мононуклеоз, менингококкцемия), с туберкулезом, менингоэнцефалитом и поражением глаз другой этиологии.
ЛЕЧЕНИЕ
При острых формах токсоплазмоза основой является этиотропная терапия. В качестве этиотропного лечения используют хлоридин (тиндурин, пириметамин, дараприм, фансидар) в сочетании с сульфаниламидными препаратами (сульфадимезин, сульфапиридазин, бактрим, лидаприм и др.). Чаще этиотропное лечение назначается циклами по 5-10 дней с перерывами между ними в 7-10 дней. Обычно проводят 3 цикла, что составляет 1 курс.
Детям с острым и подострым токсоплазмозом в первый год лечения рекомендуется проводить 2-3 курса с перерывами между ними 1,5-2 мес. Хлоридин назначают в суточной дозе 0,5-1 мг/кг массы в 2 приема после еды в таблетках. Сульфадимезин – 0,1 г/кг массы в сутки, сульфадиметоксин по 25 мг/кг в первый день и по 12,5 мг/кг в следующие дни в один прием с боржоми или содовой водой.
При хронических формах этиотропная терапия малоэффективна, ее целесообразно проводить только при наличии у больного паразитемии, т.е. в начальной стадии обострения болезни. Применяют комплексное лечение, которое включает курсы этиотропного лечения в сочетании с неспецифической десенсибилизирующей терапией (антигистаминные препараты, кортикостероиды), витаминами (С, В1, В2, Р, никотиновая кислота), иммуномодуляторами. Основное значение имеет вакцинотерапия (токсоплазминотерапия).
ПРОФИЛАКТИКА
Меры специфической активной и пассивной профилактики отсутствуют. Основу профилактики токсоплазменного инфицирования и токсоплазмоза составляют мероприятия по ограничению распространения возбудителя в окружающей среде и профилактике индивидуального инфицирования.
К мероприятиям по ограничению распространения токсоплазм в окружающей среде относится контроль за популяцией диких кошек в данной местности (отлов и уничтожение беспризорных кошек), санитарное благополучие домашних кошек (учет и плановое обследование домашних животных, лечение выявленных больных кошек, исключение из рациона домашних животных сырого мяса и субпродуктов, запрет домашним кошкам охотиться на диких грызунов, ежедневная обработка кошачьего туалета).
С целью профилактики индивидуального инфицирования запрещается употребление сырого или недостаточно термически обработанного мяса. Для разделки сырого мяса на кухне должна быть отдельная доска. Для детей достаточно значимую опасность представляют песочницы, которые практически повсеместно не имеют приспособлений для исключения доступа кошек, песок в них не подвергается сезонной обработке или замене. Столь же необходимо тщательно мыть все фрукты и овощи, употребляемые в пищу без термической обработки. Необходимо кипятить разливное молоко, не употреблять в пищу без кипячения парное молоко, в том числе и из личного подсобного хозяйства. Запрещается употребление "сырых" яиц или приготовленных "всмятку".
Серологические исследования в человеческой популяции показывают частоту инфицирования токсоплазмой в диапазоне от менее 1% молодых взрослых в одних районах, до 90% пожилых людей - в других.
Источник возбудителя - кошачьи, свинья, мыши, птицы, человек
1. немытые овощи;
2. инфицированное мясо; (в мире заражено:
0-9 % говядины нфицированно T gondii.)
Бытовой, контактный (через микротравмы наружных покровов).
Возможен половой путь передачи.
Менее часто встречается, но более клинически важна передача инфекции от человека к человеку через
инфицированные препараты крови и трансплантаты тканей.
Риск тяжелых последствий для плода тем выше, чем на более раннем сроке беременности произошло заражение женщины токсоплазмозом, но, в этот период ниже вероятность заражения плода.
На более поздних сроках беременности, процент передачи токсоплазмоза плоду очень высок, но риск
тяжелых поражений плода снижается. Потенциальная опасность инфицирования плодатоксоплазмой составляет 6% - в начале первоготриместра беременности, 40% - в конце первого и в
течение второго триместра беременности и достигает 72% - в третьем. Если женщина переболела токсоплазмозом до беременности (не менее чем за полгода до нее), ее будущему ребенку токсоплазмоз не угрожает.
В 10-20% случаев у детей и взрослых токсоплазмоз протекает в латентной форме.
В результате врождённого токсоплазмоза (трансплацентарное заражение) плод либо погибает, либо рождается с дефектами развития, либо рождается с симптомами острого врождённого токсоплазмоза.
Нарушения наиболее выражены при инфицировании плода в 1-м триместре беременности.
иктеричность кожи и склер, гепатомегалия, спленомегалия,
внутриутробный менингоэнцефалит с развитием микроцефалии, гидроцефалии, хореоретинита, слепоты, судорожногосиндрома и глухоты.
1/3 женщин, заразившихся T. gondii во время беременности, передают инфекцию трансплацентарно, оставшиеся 2/3 рожают неинфицированных детей.
Риска инфицироваться токсоплазмой нет для будущего ребенка, если заражение произошло более
чем за 6 месяцев до зачатия. Если же инфекция проникла в материнский организм позже, товероятность передачи ее плоду возрастает с приближением к моменту зачатия.
Если беременная женщина приобретает токсоплазму на первом триместе, то риск трансплацентарной передачи наиболее низок, но если это происходит, то новорожденный болеет тяжело.
При заражение матери на третьем триместре, рискзаражения плода возрастает (до 65%). Дети же
рождаются без признаков врождённой инфекции.
Острая форма приобретённого
Инкубационный период - от 4 до 21 дня (7 дней)
При развитии манифестной формы:
субфебрильная лихорадка, недомогание, миалгии, увеличение лимфатическихлимфоузлов (безболезненные, как правил одна группа, чаще затылочные, увеличение сохраняется длительно), может наблюдаться
макулопапулезная сыпь и гепатоспленомегалия.
Клиническое течение благоприятное, как правило, данная симптоматикаразрешается без лечения.
Часто развивается при врождённой форме, однако возможно и при приобретенной.
Врождённый хореоретинит, как правило, двусторонний, а приобретенный односторонний.
Признаками вовлечения глаз в инфекционный процесс является помутнение зрения, характерные ретинальные инфильтраты, развивающиеся у 85% молодых людей послеврождённого токсоплазмоза, скотома, боль, светобоязнь
Окулярный токсоплазмоз может
реактивироваться через несколько лет после первичной инфекции.
Хроническая форма токсоплазмоза
Наиболее частой встречается хроническая форма заболевания:
длительное повышение температуры до 37,2-37,8 градусов,
увеличением печени, селезёнки,
мышечными и суставными болями.
Возможно и носительство инфекции.
Хроническая форма и носительство нередко переходят в острую форму на фоне стресса, беременности, снижения Т клеточного иммунитета (гематологические заболевания, трансплантация костного мозга
и паренхиматозных органов, ВИЧ-инфекция)
При первичном инфицировании Т. gondii начинается выработка антител класса М (IgM). Современные методы диагностики позволяют обнаружить их через 14 дней от момента инфицирования.
В последующие месяцы уровень IgM снижается и определяется в крови не более 1 года.
Антитела этого класса не образуются при реактивации инфекции. Поэтому качественное определение IgM ктоксоплазме дает быстрое подтверждение острой или недавней инфекции.
IgM не проникают через плаценту, поэтому они могут бытьиспользованы в качестве маркера эмбриональной инфекции. Одновременное определение IgM в крови новорожденного и матери позволяет проводить раннюю диагностику врожденного токсоплазмоза.
В отличие от IgM уровень IgG возрастает в течение 14 дней после первого определенияIgM и остается постоянным неограниченное количество времени (в течение жизни).Постоянный титр IgG указывает на
более раннее инфицирование.
Четырехкратное и более увеличение титра IgG указывает на активную инфекцию.
IgG проникают через плаценту, поэтому последовательное многократное определениеуровня IgG у новорожденного позволяет отличить врожденное заражение (постоянный уровень) от неонатального (рост титра).
Род хламидия включает в себя
Chlamidia trachomatis является фактором, вызывающим трахому, и наиболее распространенным в мире возбудителеммикробных инфекций, передающихсяполовым путем.
По данным CDS, ежегодно инфицируются 3 млн. человек.
Хламидиозом поражено 30-50% женщин и до51% мужчин, страдающих не гонококковыми воспалительными заболеваниями мочеполовых органов.Клинические формы урогенитального
хламидиоза органов малого таза и других отделов мочеполовой системы:
В отсутствие лечения генитальная хламидийная инфекция у мужчин (не гонококковый и пост
гонококковый уретрит) может привести кпростатиту, эпидидимиту, везикулиту,
фуникуллиту и нередко к нарушению половой потенции и, как следствие, к бесплодию.
У женщин хламидийная инфекция в большинстве случаев начинается с цервицита,
который долгое время может оставаться бессимптомным. У половины инфицированных
женщин возникает эндометрит. При дальнейшем течении инфекция распространяется вверх и поражает
фаллопиевы трубы с высоким риском внематочной беременности или бесплодия из-за закрытия труб.
Экстрагенитальная хламидийная инфекция
- хламидийная инфекция аноректальной области.
Чаще всего инфицирование новорожденных происходит интранатально.
Второй путь заражения плода – антенатальный (внутриутробный). В этом случае хламидийная
инфекция в раннем неонатальном периоде жизни ребенка протекает с тяжелыми клиническими проявлениями.
Риск инфицирования новорожденных при физиологических родах превышает 50%, у
половины инфекция у новорожденныхпротекает бессимптомно. Реже отмечаются
случаи хламидийной инфекции уноворождённых после кесарева сечения.
Формы хламидиоза новорожденных:
синдром дыхательных расстройств
ВОЗ рекомендует обследовать на
хламидиоз в следующих случаях:
1. Хронические воспалительные заболевания
2. Акушерско-гинекологическая патология.
4. Псевдоэрозия шейки матки и др.
5. Реактивный артрит.
6. Хронический конъюнктивит.
7. Атипичная пневмония.
8. Лихорадка неясного генеза.
9. Нарушения менструального цикла.
10. Самопроизвольные и искусственные аборты
11. Лечебные и диагностические выскабливания слизистой оболочки шейки матки и тела матки
12. Ввведение и удаление внутриматочных контрацептивов и другие внутриматочные
13. Хронический цистит
14. Новорожденные при наличии диагностированной хламидийной инфекции у матери
15. Патология периода новорожденности
16. Наличие ИППП
17. Половые контакты с лицами, инфицированными хламидиями
18. Частая смена половых партнеров
19. Декретированный контингент
Doxycycline (тетрациклин) старше 8 лет;
Ofloxacin (фторхинолон) дороже 1-2,
Ampicillin как и erythrocin, amoxicillin
рекомендуются для лечения мочеполовой
хламидийной инфекции только для
Относительно слабая контагиозность.
Длительное носительство возбудителя.
Высокая частота бессимптомных и легких форм инфекции, особенно среди детей до 5 лет.
Медленное и продолжительное (до 3-5 месяцев) развитие вспышек, отсутствие обширных эпидемий.
Источник инфекции - больные в остром периоде заболевания или носители.
Отмечена определенная цикличность респираторного микоплазмоза с подъемом заболеваемости с
интервалом 2-4 года.
М. pneumoniae распространена повсеместно.
Составляет около 10% всех случаев пневмоний в тесно взаимодействующих коллективах.
Практически не встречается среди госпитальных пневмоний.
Заболевают, главным образом, дети школьного возраста и взрослые в периодвспышек микоплазменных инфекций (осенне-зимний период). Однако заболевания наблюдаются в течение всего года.
Ежегодно регистрируется 8-15 млн. случаев заболевания.
М. pneumoniae является этиологическим агентом респираторной инфекции:
☻ в 21% случаев у детей 5-14 лет,
☻ в 16% случаев у подростков и молодежи 15 -23 лет,
☻ в 20% случаев у людей 24 - 60 лет
☻ в 7% случаев у людей старшего возраста.
☻ воспалительные инфекции верхних
дыхательных путей (фарингита, трахеобронхита)
Заболевания суставов микоплазменной этиологии
Потенциально патогенные для
1. По клинико-морфологическимпризнакам микоплазменные инфекции
сходны с заболеваниями, вызываемыми другими микроорганизмами: хламидиями,
вирусами, грибами, они не имеютсобственных клинических проявлений, что весьма осложняет диагностику и поэтому главенствующая роль принадлежит лабораторной диагностике и получению эпидемиологических данных.
2. Микоплазменные инфекции могут протекат остро, но чаще имеют хроническое рецидивирующее течение.
3. Развитие микоплазмозов в значительной степени определяется чувствительностьюхозяина к инфекции. Данные о генетическом детерминировании чувствительности к микоплазмам получены при моделировании
инфекции на конгенных мышах.
4. Характер патологического процесса зависит от входных ворот инфекции. Так, М. hominis может вызывать у человека фарингит и заболевания урогенитального тракта. Влитературе описано несколько случаев
пневмонии, вызванной М. hominis. При внутриутробном микоплазмозе плода инфекцияразвивается в верхних дыхательных путях, легких, урогенитальном тракте, ЦНС.
Нереспираторные проявления микоплазмоза
полиморфная эритема и менингит,
транзиторная гемолитическая анемия,
острой почечной недостаточности,
тромбозу бедренной артерии,
гангрена пальцев стопы,
миалгии и артралгии
тяжелые поражения печени
тяжелые поражения поджелудочной железы (повышение амилазы и сахара крови)
миокардит, перикардит и эндокардит (1 – 8,5%), полная блокада пучка Гисса, сердечная тампонада и
гипертрофическая кардиомиопатия (изперикарда был выделен возбудитель).
поражение центральной нервной системы
( 3 – 4%), микоплазмы обнаружены в ликворе и ткани мозга (энцефалит, менингит, мозжечковая атаксия, неврит черепно-мозговых и периферическихнервов). Возможны полирадикулоневрита и психоза.
Метациклин - по 0,9 г в сутки перорально - 10
Doxycycline - 0,4 г перорально - 1-й день 0,3 г,
2-й день 0,2 г - 6 дней
Erythrocin- по 2,0 - 4,0 г в сутки в течение 10-
Линкомицин – по 2,0-3,0 г. в сутки в течение
Таривид - по 0,4 г в сутки в течение 6 дней
Ровамицин(спирамицин) - 6-7 млн. ED
перорально (суточная доза) - 2 - 3 раза в сутки.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Паразитарное заболевание, характеризующееся поражением скелетной мускулатуры, мышцы сердца, нервной системы, увеличением селезенки и печени, называется токсоплазмозом. Возбудителем инфекции является паразит Toxoplasma gondii, основным методом выявления которого является серологический анализ крови на определение антител.
Анализ на токсоплазмоз
В настоящее время своевременное исследование крови на токсоплазмоз позволяет не только стабилизировать, но и вовсе избавиться от инфекции. Анализ на выявление токсоплазмы назначается:
- женщинам, планирующим беременность или уже после зачатия;
- людям с ослабленным иммунитетом;
- при увеличении лимфатических узлов без видимых причин;
- ВИЧ-инфицированным пациентам;
- при болезненности неизвестного происхождения, сопровождающейся жаром, ознобом;
- при одновременном увеличении селезенки и печени;
- после пересадки органов или переливания крови;
- если предыдущий результат анализа был сомнительным.
Современная медицина предлагает несколько видов анализов на токсоплазмоз. Самыми популярными методами являются:
- ИФА. Аббревиатура расшифровывается как иммуноферментный анализ, во время которого выявляются в крови иммуноглобулины IgG и IgM (G и M). Это антитела, которые вырабатывает организм на проникновение возбудителя. Во время инфицирования иммуноглобулины накапливаются в разных концентрациях в крови – это называется титры антител.
- ПЦР. Полимерная цепная реакция используется, если анализ крови на токсоплазмоз дал сомнительный результат. Суть метода заключается в выявлении ДНК и РНК молекул возбудителя. Для исследования берут образец мочи, крови, слюны носителя.

Что такое антитела к токсоплазме
При появлении паразитов организм начинает реагировать, активно продуцируя иммуноглобулин класса G и M. Эти антитела защищают человека от инфекции. Обнаруживая патогенные бактерии, которые активно размножаются в кишечнике, иммуноглобулины разрушают их клеточную структуру, что со временем приводит микробы к гибели. Антитела в организме человека остаются навсегда. При последующем заражении иммунная система сразу подавляет патогенные микроорганизмы, поэтому у них нет возможности навредить здоровью.
Иммуноглобулины группы М
Если обнаружен токсоплазмоз в крови, то первыми выработают ответ на острую инфекцию иммуноглобулины М (IgM). Они являются показателем гуморального иммунитета, который осуществляет защиту организма от белков-антигенов, растворимых в крови или других жидкостях. Антитела класса М к токсоплазме появляются в крови уже на 2-3 сутки после проникновения чужеродных микроорганизмов, достигая максимального количества на 21 день. Через 2 месяца после заражения количество иммуноглобулина lgM снижается почти до нуля.
Anti toxoplasma gondii igg
Антитела класса G к токсоплазме после инфицирования в крови у носителя появляются позже (спустя несколько недель), но остаются дольше (до 2 лет). Наличие в анализе Anti toxoplasma gondii igg указывает на то, что ранее организм уже встречался с этой инфекцией, и он ее распознал. При обнаружении антител G можно также говорить о хроническом течении инфекции. На данной стадии лечение токсоплазмоза не требуется. Определенное количество иммуноглобулина IgG в крови сохраняется в течение всей жизни человека, даже после выздоровления.
Чем отличаются антитела IgG и IgM
Обнаруженные в крови антитела M говорят врачу о недавнем заражении пациента токсоплазмозом. Количество IgM составляет всего 10% среди всех иммуноглобулинов. Если он повышен, то это указывает на наличие в организме инфекции и воспаления. Если показатели антител IgM низкие, то это свидетельствует об иммунодефиците. Иммуноглобулины anti Toxoplasma Gondii IgG самые распространенные. Их количество составляет 80% от общих показателей антител. Благодаря большой функциональности, антитела к токсоплазме IgG обеспечивают положительное влияние организм:
- усиливают защитные силы;
- нейтрализуют токсические вещества;
- способствуют формированию иммунитета у плода при беременности.
Расшифровка показателей
Исследование крови на антитела делается при помощи ИФА (иммуноферментного анализа). Он имеет пороговые (предельно допустимые) и референтные (средние) значения. Если величина маркеров ниже порового титра, то результат анализа отрицательный, а если выше – положительный. В каждой лаборатории существуют свои нормы показателей иммуноглобулина IgG. Расшифровка показателей в различных комбинациях:
Стойкий иммунитет к токсоплазме отсутствует (опасность первичного инфицирования)
Имеется постинфекционный или поствакцинальный иммунитет (отсутствие заражения)
Острая первичная инфекция
Обострение хронической инфекции
Расшифровка иммуноферментного анализа по показателям авидности
Для определения фазы развития и продолжительности болезни иногда проводится дополнительное исследование иммуноглобулинов. В результате лабораторного анализа сыворотки крови получают индекс авидности к токсоплазме. Изучение антител таким способом дает быструю возможность узнать прочность их связи с чужеродным агентом. Чем дольше находится инфекция в организме, тем выше значение авидности.
От полученных результатов зависит решение врача о назначении лекарственной терапии против паразитов. Особенно актуально данное исследование для пациенток, планирующих беременность, ведь первичное инфицирование грозит серьезными осложнениями во время вынашивания ребенка. Для диагностики важны показатели антител G к токсоплазме, так как с ними легко определить время заражения пациента. Существует три степени авидности:
В крови обнаружены низкоавидные антитела lgG
Недавняя первичная инфекция
Неопределенный результат, при котором требуется повторный анализ через пару недель
Антитела к токсоплазмозу при беременности
Если у женщины во время беременности выявили токсоплазмоз lgG положительный при отсутствии антител IgM, то это означает, что в прошлом у нее был контакт с данной инфекцией, поэтому сейчас есть стойкий иммунитет, который будет защищать от вторичного инфицирования. Такой результат показывает, что иммуноглобулины класса G будут защищать и ребенка в утробе матери, ведь они легко проникают через плацентарный барьер.
Если же у будущей мамы обнаружился положительный IgM при отсутствии IgG, то это опасный фактор для еще нерожденного ребенка. Если первичное заражение токсоплазмой произошло на 12-й неделе беременности, то повышается угроза развития у плода врожденных аномалий, ведь в этот период у эмбриона происходит развитие почек, печени и других частей тела. В некоторых случаях патологические изменения в организме ребенка приводят к его гибели при рождении.
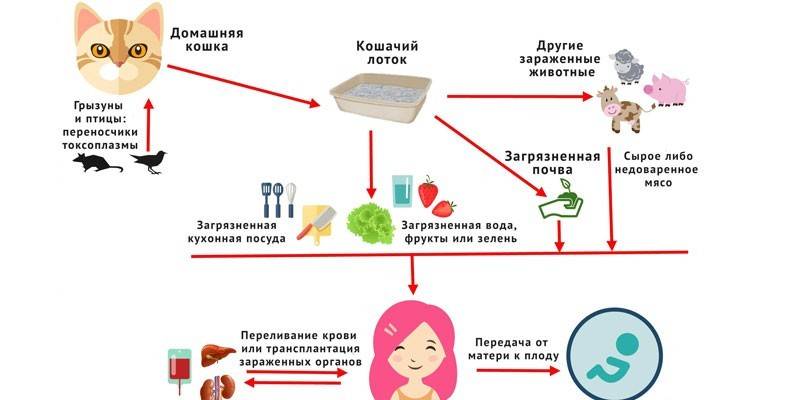
Прогрессирование токсоплазмы у беременной до 30-й недели может спровоцировать у малыша поражение органов зрения и/или головного мозга. Инфекция, полученная будущей мамой на этой стадии беременности, может привести к следующим патологиям у ребенка:
- гидроцефалия (водянка головного мозга);
- полная слепота;
- недоразвитие катаракты и головного мозга.
При тяжелой форме инфекции у ребенка могут наблюдаться поражение печени, селезенки, системы кроветворения, органов пищеварения. Если токсоплазма прогрессирует или остается без лечения, то у беременной женщины может произойти выкидыш. Если заражение произошло на последних сроках, то велик риск преждевременных родов. В период грудного вскармливания, если у матери нет активной формы токсоплазмоза, инфицирование через материнское молоко исключено.
Совсем недавно диагностирование токсоплазмоза во время беременности было основным показанием для ее прерывания. Сегодня женщина с этой патологией находится у врачей на индивидуальном контроле и нуждается в проведении дополнительных клинических исследований. Основные показания к сдаче анализа на токсоплазмоз у беременных:
- полное отсутствие аппетита;
- ломота в теле;
- общая слабость;
- нарушение сна;
- расстройство кишечника;
- повышение температуры тела до 38 °С;
- увеличенная в размерах печень;
- повышенная потливость;
- болезненные ощущения в горле;
- увеличенные лимфатические узлы.
Что делать, если IgM положительный
Лечение токсоплазмы у беременных начинают с 12–16 недели. Если выявлены положительные антитела к токсоплазме IgM при отсутствии IgG (первичное заражение) на раннем сроке, то женщине предлагается сделать аборт. Это связано с тем, что для избавления от токсоплазмы необходимо принимать антибиотики, которые негативно повлияют на развитие плода.
При отсутствии внутриутробного заражения (по результатам ПЦР амниотической жидкости) врачи назначают антибактериальные препараты макролидного ряда: Спирамицин, Макропен. Они способны накапливаться в плаценте, предотвращая вертикальный путь передачи токсоплазмы.
При инфицировании плода и бессимптомном течении инфекции у беременной фармакотерапия состоит из противомалярийного (Пириметамин) и противомикробного (Сульфадиазин) препаратов. Первый подавляет в костном мозге деление клеток, а второй является мощным противопаразитарным средством. Лечение хронической токсоплазмы проводят в зависимости от характера поражения, выраженности клинической симптоматики, возраста пациентки, состояния иммунитета. Применяют следующие группы препаратов:
- Противовирусные. После приема встраиваются в ДНК вирусы, подавляя его синтез (Ганцикловир, Панавир, Фоскарнет).
- Иммуноглобулины. Способны формировать иммунитет беременной женщины и ребенка (Пентаглобин, Октагам).
- Интерфероны. Сдерживают активное размножение вирусных частиц, ограничивают их передвижение (Виферон, Реальдирон).

В основе профилактики заражения токсоплазмой лежит выполнение норм гигиены, выбор безопасных способов приготовления пищи, соблюдение правил содержания домашних животных. Для уменьшения риска инфицирования следует:
- мыть руки до и после приготовления еды;
- во время обработки почвы носить перчатки;
- не употреблять в пищу сырое козье молоко;
- избегать употребления недостаточно приготовленного или сырого мяса;
- перед употреблением всегда мыть овощи, фрукты и ягоды;
- избегать непосредственного контакта с испражнениями кошек (менять лоток в перчатках).
Читайте также:


