Шига токсин у кишечной палочки

Энтерогеморрагические кишечные палочки (энтерогеморрагические Escherichia coli, аббревиатуры: EHEC или ЭГКП) — патогенные штаммы бактерий, относящиеся к виду Escherichia coli (синоним кишечная палочка), являющиеся возбудителями эпидемических вспышек геморрагических колитов у взрослых. Большинство штаммов бактерий вида Escherichia coli, относящегося к роду эшерихия (Escherichia) семейства энтеробактерии (Enterobacteriaceae), являются частью нормальной микрофлоры кишечника человека и безвредны.
Энтерогеморрагические E. coli, выделяющие шига-токсин (синоним веротоксин), обозначаются STEC (VTEC). Считается, что этот токсин может являться причиной гемолитико-уремического синдрома (ГУС), сопровождающегося кровавым поносом, который в некоторых случаях приводит к острой почечной недостаточности, требующей интенсивного лечения. Существует несколько штаммов STEC и их идентификация служит более точному определению источника заболевания.

Симптомы болезней, вызываемых энтерогеморрагическими E. coli, включают абдоминальные спазмы и диарею, которая в некоторых случаях может переходить в кровавый понос (геморрагический колит). Возможны также жар и рвота. Инкубационный период длится от трех до восьми дней, при средней продолжительности три-четыре дня. Большинство больных выздоравливает в течение 10 дней, но у незначительного числа больных (особенно детей раннего возраста и пожилых людей) болезнь может принять тяжелую форму с угрозой для жизни, такую как гемолитический уремический синдром (ГУС). Для ГУС характерны острая почечная недостаточность, гемолитическая анемия и тромбоцитопения. По информации ВОЗ, у 10 % пациентов с инфекцией вызываемых энтерогеморрагическими E. coli может развиться ГУС с коэффициентом летальности от 3 до 5 %. Во всем мире ГУС является самой распространенной причиной острой почечной недостаточности у детей раннего возраста. Он может привести к неврологическим осложнениям (таким как конвульсии, инсульт и кома) у 25 % пациентов и хроническим заболеваниям почек, обычно не тяжелым, примерно у 50 % выживших пациентов.
Заболеваемость инфекциями вызываемых энтерогеморрагическими E. coli зависит о возрастной группы. Наибольшее количество зарегистрированных случаев заболевания приходится на детей в возрасте до 15 лет (0,7 случаев на 100 000 в США). 63-85 % случаев заболевания происходит в результате воздействия патогенных микроорганизмов, содержащихся в пищевых продуктах. Доля инфекций вызываемых энтерогеморрагическими E. coli, которые приводят к развитию ГУС, составляет 3-7 % в спорадических случаях заболевания и 20 % и более в случае вспышек. С точки зрения эпидемиологии, как правило, происходят спорадические случаи заболевания со случающимися время от времени вспышками. Некоторые из этих вспышек охватывают большое количество случаев заболевания. Вспышка в Японии в 1996 г., во время которой употребление в пищу зараженных ростков редиса, содержащихся в школьных завтраках, привело к 9 451 случаю заболевания.

Резервуаром энтерогеморрагических кишечных палочек серотипа O157:H7 является, в основном, крупный рогатый скот и другие жвачные животные. Они передается человеку, главным образом, в результате употребления в пищу зараженных продуктов, таких как сырые или не прошедшие достаточную тепловую обработку мясные продукты и сырое молоко. Загрязнение фекалиями воды и других пищевых продуктов, а также перекрестное загрязнение во время приготовления пищи (через продукты из говядины и другого мяса, загрязненные рабочие поверхности и кухонные принадлежности) также могут привести к заболеванию. Так, к возникновению вспышек энтерогеморрагических кишечных палочек O157:H7 привело употребление в пищу таких продуктов, как не прошедшие должную тепловую обработку гамбургеры, копченая салями, непастеризованный свежевыжатый яблочный сок, йогурт, сыр и молоко. Все большее количество вспышек связано с употреблением в пищу фруктов и овощей (ростков, латука, капусты, салатов), заражение которых происходит, по всей вероятности, в результате контакта с фекалиями домашних и диких животных на какой-либо стадии их культивирования или обработки. Энтерогеморрагические кишечные палочки были также обнаружены в водоемах (прудах, реках), колодцах и поилках для скота. Они могут оставаться жизнеспособными в течение нескольких месяцев в навозе, попадающем в эти водоемы, и осадочных отложениях на дне поилок. Передача инфекции происходит как через зараженную питьевую воду, так и через воды для рекреационного использования.
Близкие контакты людей являются одним из основных путей передачи инфекции (орально-фекальный путь заражения). Были зарегистрированы бессимптомные носители, то есть лица, у которых не проявляются клинические симптомы болезни, но которые способны инфицировать других людей. Период выведения из организма энтерогеморрагических кишечных палочек у взрослых длится одну неделю и менее. У детей этот период может быть более длительным. В числе важных факторов риска отмечается также посещение ферм и других мест содержания животных, где возможен прямой контакт с ними.
За последние годы значительно возросла популярность проросших семян. В то же время, увеличилось число вспышек болезней пищевого происхождения, связанных с употреблением в пищу сырых ростков растений. Проведенные расследования этих вспышек показали, что патогенные микроорганизмы, обнаруженные на ростках, по всей вероятности, происходят из семян. С проросшими семенами связывают инфекцию энтерогеморрагической кишечной палочкой (серотип O104:H4) мая-июня 2011 года в Германии с заметным числом летальных исходов, а также инфекцию, начавшуюся в июне 2011 года в Бордо (Франция). В 1996 году в Японии произошла вспышка инфекции кишечной палочки серотип О157:H7, связанная с употреблением в пищу проростков редиса: число заболевших превысило 9000. Начиная с 2000 года в мире зарегистрировано 28 вспышек, связанных с употреблением в пищу проросших семян, зараженных кишечной палочкой или сальмонеллами.
Заражение семян может происходить в полях или во время сбора урожая, хранения и транспортировки. Во время процесса проращивания семян патогенные микроорганизмы, присутствующие в семенах в незначительных количествах, могут быстро достигать достаточно высоких для инфицирования людей количеств. Поэтому при производстве и потреблении ростков растений необходимо соблюдать особые меры предосторожности.
Таким образом, вспышки эшерихиозов и сальмонеллезов могут быть связаны с употреблением проростков редиса, люцерны, бобов и клевера.
Институт санитарно-эпидемиологического надзора, Франция, опубликовал 28.6.2011 г. обновленные данные в отношении вспышки инфекции, вызванной VTEC в сочетании с ГУС, в г. Бордо (Франция). В общей сложности за период с 22 июня зарегистрировано 8 случаев инфекции энтерогеморрагической кишечной палочкой и 8 случаев ГУС. Данная вспышка не связана с поездками в Германию. В 4 случаях обнаружена кишечная палочка O104:H4. В единственном случае, завершившемся смертельным исходом, кишечная палочка серотипа O104:H4 обнаружена не была.
Исследования показали, что штаммы кишечной палочки, вызвавшие вспышки в Германии и Франции генетически неразличимы, что свидетельствует о том, что обе вспышки имеют общий источник. Имеется также один изолированный случай в Швеции.
По предварительным данным (информация ВОЗ от 7.7.2011) наиболее вероятным общим звеном между двумя вспышками стала партия семян пажитника, импортированная из Египта и использованная для производства проростков.
В таблице приведена сводная информация ВОЗ согласно последнему информационному бюллетеню № 30 о зарегистрированных во всех странах мира случаях заболеваний и смертельных исходов, связанных с инфекцией энтероагрегативной вероцитотоксин-продуцирующей кишечной палочки O104:H4, за период с начала вспышки в Германии 1 мая 2011 г. (по состоянию на 21.7.2011 года). В общей сложности из 16 стран Европы и Северной Америки поступили сообщения о 4075 случаев инфекции кишечной палочки O104:H4, в том числе 50 – со смертельным исходом.
Жертвой кишечной инфекции, распространившейся с прошлой недели в Германии, в ночь на четверг стала еще одна женщина, сообщил пресс-секретарь университетской клиники Эппендорф в Гамбурге, которого цитирует телеканал N-24. Инфекцию в Германии вызвала так называемая энтерогеморрагическая бактерия Escherichia coli (кишечная палочка).
Бактерия Escherichia coli (E. coli) стала рассматриваться в качестве проблемы общественного здравоохранения с 1982 г., после вспышки заболевания в Соединенных Штатах Америки.
E. coli часто можно обнаружить в кишечниках людей и теплокровных животных. Большинство штаммов E. coli безвредны. Однако некоторые штаммы, такие как, например, энтерогеморрагическая E. coli (EHEC) могут вызывать тяжелые болезни пищевого происхождения. Эта бактерия передается человеку, главным образом, при потреблении зараженных пищевых продуктов, таких как сырые или не прошедшие достаточную тепловую обработку мясные продукты или сырое молоко.
EHEC производит токсины, известные, как веротоксины или шигатоксины, названные так из-за их сходства с токсинами, производимыми шигеллами (бактериями) дизентерии.
Количество бактерий EHEC может увеличиваться при температуре от +7 до +50°С (оптимальная температура +37°С). Количество некоторых бактерий EHEC может расти в кислых продуктах.
Бактерии погибают при тщательной тепловой обработке продуктов - при нагревании всех частей продуктов до температуры 70°С или выше.
Болезни, вызываемые EHEC
Симптомы болезней, вызываемых бактериями EHEC, включают абдоминальные спазмы (спазмы гладких мышц органов брюшной полости) и диарею, которая в некоторых случаях может переходить в кровавую диарею (геморрагический колит). Возможны жар и рвота.
Инкубационный период длится от трех до восьми дней, при средней продолжительности три-четыре дня. Большинство пациентов выздоравливает в течение 10 дней, но у незначительного числа пациентов (особенно детей раннего возраста и пожилых людей) болезнь может принять тяжелую форму с угрозой для жизни - гемолитический уремический синдром (ГУС). Для ГУС характерны острая почечная недостаточность, гемолитическая анемия (анемия, при которой разрушение красных клеток крови (эритроцитов) происходит быстрее, чем их наработка костным мозгом) и тромбоцитопения (уменьшение количества тромбоцитов ‑ менее 200 тыс. в 1 куб. мм - в периферической крови).
По оценкам, у 10 % пациентов с инфекцией EHEC может развиться ГУС с коэффициентом летальности от 3 до 5 %. Во всем мире ГУС является самой распространенной причиной острой почечной недостаточности у детей раннего возраста. Он может привести к неврологическим осложнениям (таким как конвульсии, инсульт и кома) у 25 % пациентов и хроническим заболеваниям почек, обычно нетяжелым, примерно у 50 % выживших пациентов.
Заболеваемость инфекциями EHEC зависит о возрастной группы. Наибольшее количество зарегистрированных случаев заболевания приходится на детей в возрасте до 15 лет. 63-85 % случаев заболевания происходит в результате воздействия патогенных микроорганизмов, содержащихся в пищевых продуктах. Доля инфекций EHEC, которые приводят к развитию ГУС, составляет 3-7 % в спорадических (единичных) случаях заболевания и 20 % и более в случае вспышек.
Источники инфекции
Резервуаром этого патогенного микроорганизма является, в основном, крупный рогатый скот и другие жвачные животные, такие как, например, верблюды. Он передается человеку, главным образом, в результате употребления в пищу зараженных продуктов, таких как сырые или не прошедшие достаточную тепловую обработку мясные продукты и сырое молоко.
Загрязнение фекалиями воды и других пищевых продуктов, а также перекрестное загрязнение во время приготовления пищи (через продукты из говядины и другого мяса, загрязненные рабочие поверхности и кухонные принадлежности) также могут привести к заболеванию.
Все большее количество вспышек связано с употреблением в пищу фруктов и овощей (ростков, латука, капусты, салатов), заражение которых происходит, по всей вероятности, в результате контакта с фекалиями домашних и диких животных на какой-либо стадии их культивирования или обработки. Бактерии EHEC были также обнаружены в водоемах (прудах, реках), колодцах и поилках для скота. Они могут оставаться жизнеспособными в течение нескольких месяцев в навозе, попадающем в эти водоемы, и осадочных отложениях на дне поилок. Передача инфекции была зарегистрирована как через зараженную питьевую воду, так и через воды для рекреационного использования.
Близкие контакты людей являются одним из основных путей передачи инфекции (орально-фекальный путь заражения). Были зарегистрированы бессимптомные носители, то есть лица, у которых не проявляются клинические симптомы болезни, но которые способны инфицировать других людей.
Период выведения из организма бактерий EHEC у взрослых людей длится одну неделю и менее. У детей этот период может быть более длительным. В числе важных факторов риска отмечается также посещение ферм и других мест содержания животных, где возможен прямой контакт с ними.
Методы контроля и профилактики
Для профилактики инфекции необходимо соблюдать контрольные меры на всех стадиях пищевой цепи - от производства сельскохозяйственной продукции на фермах до обработки, переработки и приготовления пищевых продуктов как на коммерческих предприятиях, так и в домашних условиях.
Единственным эффективным способом уничтожения бактерий EHEC в пищевых продуктах является бактерицидная обработка, такая как нагревание (например, тепловая обработка или пастеризация) или облучение.
Соблюдение основных принципов надлежащей практики гигиены пищевых продуктов может предотвратить передачу патогенных микроорганизмов, являющихся возбудителями многих болезней пищевого происхождения, а также защитить от болезней, вызываемых бактериями EHEC.
Материал подготовлен на основе информации открытых источников

Кишечная палочка (E.coli) представляет собой грамотрицательные, палочковидные бактерии, которые обычно находятся в нижней части кишечника теплокровных (эндотермических) организмов. Большинство штаммов кишечной палочки безвредны, но некоторые серотипы являются патогенными и могут вызвать серьезное пищевое отравление у людей, и их наличие в продукции может даже повлечь за собой отзыв продуктов с рынка. Безвредные штаммы являются частью нормальной флоры кишечника, и могут быть полезны для организма, поскольку производят витамин К2 и предотвращают производство патогенных бактерий в кишечнике. 1)
Введение
Кишечная палочка и родственные бактерии составляют около 0,1% от кишечной флоры, и фекально-оральный путь передачи является основным маршрутом, через который патогенные штаммы бактерии вызывают болезни. Клетки способны выживать вне тела в течение ограниченного промежутка времени, что делает их идеальными индикаторными организмами для тестирования проб окружающей среды относительно фекального загрязнения. Бактерия также может быть выращена легко и недорого в лабораторных условиях, и интенсивно исследуется на протяжении более 60 лет. Кишечная палочка является наиболее широко изученной прокариотической моделью организма, а также важным видов в области биотехнологии и микробиологии, где служит в качестве организма-хозяина для большей части работ с рекомбинантной ДНК. Немецкий врач-педиатр и бактериолог Теодор Эшерих обнаружили кишечную палочку в 1885 году, и теперь она классифицируется как часть семейства Enterobacteriaceae гамма-протеобактерий. 2)
Серотипы
Патогенные штаммы E. coli могут быть категоризированы на основании элементов, которые могут вызывать иммунный ответ у животных, а именно: O антиген: часть липополисахаридного слоя K антиген: капсула H антиген: флагеллин Например, штамм Е. coli EDL933 принадлежит к группе O157: H7.
Наружная мембрана клетки палочки Е. содержит миллионы молекул липополисахаридов (LPS), которые состоят из:
Антиген O используется для серотипирования кишечной палочки и эти обозначения группы O идут от O1 до O181, за исключением некоторых групп, которые исторически были удалены, а именно, O31, O47, O72, О67, O93 (ныне K84), O94 и O122; группы 174 до 181 являются предварительными (O174 = OX3 и O175 = OX7) или изучаются (от 176 до 181 – STEC / VTEC). Кроме того, существуют подтипы для многих групп O (например, O128ab и O128ac). Следует отметить, однако, что антитела по отношению к нескольким антигенам O перекрестно реагируют с другими антигенами O и частично с K антигенами не только из E.coli, но и от других видов бактерий Escherichia и вида Enterobacteriaceae. 3) Антиген O кодируется генным кластером rfb. Рол (cld) ген кодирует регулятор длины липополисахаридной O-цепи.
Кислый капсульный полисахарид (КПС) представляет собой толстый слизистый слой полисахарида, который окружает некоторые патогены E.coli. Существуют две отдельные группы K-антигеновых групп, называемые группа I и группа II (в то время как небольшая промежуточная группа (K3, K10 и K54 / K96) была классифицирована как группа III). Первая (I) группа состоит из 100 кДа (крупных) капсульных полисахаридов, а вторая (II) связана с внекишечными заболеваниями и имеет размер меньше 50 кДа. Группа IK антигенов обнаруживаются только с определенными О-антигенами (группы О8, O9, O20 и O101), далее они подразделяются на основании отсутствия (IA, аналогично видам Klebsiella в структуре) или присутствия (IB) аминосахаров и некоторые K-антигены группы I прикреплены к липидному А-ядру липополисахарида (KLPS), аналогичным образом, как антигены O (и, будучи структурно идентичны антигенам O, в некоторых случаях рассматриваются только как K антигены при совместной экспрессии с другим подлинным антигеном O). Антигены из группы II K напоминают антигены грам-положительных бактерий и сильно различаются по составу и далее подразделяются в соответствии с их кислотными компонентами. Как правило, 20-50% цепей КПС связаны с фосфолипидами. В общей сложности, насчитывается 60 различных K антигенов, которые были признаны (K1, K2A / переменного тока, К3, К4, К5, К6, К7 (= K56), К8, К9 (= O104), K10, K11, K12 (K82), K13 (= K20 и = K23), K14, K15, K16, K18a, K18ab (= K22), K19, K24, K26, K27, K28, K29, K30, K31, K34, K37, K39, K40, K41, K42 , K43, K44, K45, K46, K47, K49 (o46), K50, K51, K52, K53, K54 (= K96), K55, K74, K84, K85ab / акр (= O141), K87 (= O32), K92, K93, K95, K97, K98, K100, K101, K102, K103, KX104, KX105, и KX106).
Антиген Н является основным компонентом жгутиков, участвующим в движении кишечной палочки. Он, как правило, кодируется геном FLIC. Существует 53 идентифицированных антигена H, пронумерованных от H1 до Н56 (Н13 и Н22 не были антигенами E.coli, но входят в группу Citrobacter freundii и было обнаружено, что Н50 – это то же самое, что H10). 4)
Роль в развитии болезней
У людей и у домашних животных, вирулентные штаммы кишечной палочки могут вызывать различные заболевания. В организме человека: гастроэнтерит, инфекции мочевых путей, а также менингит у новорожденных. В более редких случаях, вирулентные штаммы также могут вызывать гемолитико-уремический синдром, перитонит, мастит, септицемию и грамотрицательную пневмонию.
Каждая отдельная бактерия представляет собой округлый цилиндр. Некоторые штаммы кишечной палочки, такие как O157: H7, O104: H4, O121, O26, O103, O111, O145 и O104: H21, производят потенциально смертельные токсины. Пищевое отравление, вызванное кишечной палочкой, может быть вызвано употреблением в пищу немытых овощей или плохо разделанного и плохо приготовленного мяса. O157: H7 также печально известно благодаря тому, что вызывает серьезные и даже угрожающие жизни осложнения, такие как гемолитико-уремический синдром. Этот штамм связан со вспышками кишечной палочки 2006 года в США из-за свежего шпината. O104: H4 штамм является одинаково вирулентным. Против него не так хорошо развиты методы лечения антибиотиками и поддерживающие протоколы лечения (он может быть очень энтерогеморрагическим, как O157: H7, вызывая кровавый понос, но и более энтероагрегативным, то есть, он хорошо адгезируется и прилипает к кишечным мембранам). Этот штамм ответственен за смертельную вспышку кишечной палочки в Европе в июне 2011 года. Степень тяжести заболевания значительно варьирует; это может привести к летальному исходу, особенно у детей младшего возраста, пожилых людей или лиц с ослабленным иммунитетом, но чаще протекает в более мягкой форме. Ранее, в 1996 году, плохая гигиена при приготовлении мяса в Шотландии вызвала гибель семи человек из-за отравления кишечной палочкой, и сотни человек получили заражение. Кишечная палочка может питать как термостойких, так и термолабильных энтеротоксинов. Последние, названные LT, содержат одну А субъединицу и пять В субъединиц, расположенных в одном голотоксине, и в высокой степени сходны по своей структуре и функции с холерными токсинами. В субъединицы способствуют присоединению и вступлению токсина в кишечные клетки-хозяева, в то время как А субъединица расщепляется и предотвращает поглощению воды клетками, вызывая диарею. LT секретируется в ходе типа 2 пути секреции. Если бактерии кишечной палочки избегают желудочно-кишечного тракта через перфорацию (например, от язвы, разорванного аппендикса, или из-за хирургической ошибки) и проникают в живот, они обычно вызывают перитонит, который могут привести к летальному исходу без своевременного лечения. Тем не менее, кишечная палочка чрезвычайно чувствительна к таким антибиотикам, как стрептомицин или гентамицин. Последние исследования показывают, что лечение энтеропатогенной кишечной палочки антибиотиками может не улучшить исход заболевания, поскольку это может значительно увеличить вероятность развития гемолитического-уремического синдрома. 5) E.coli в слизистой оболочке кишечника наблюдаются в повышенных количествах при воспалительных заболеваниях кишечника, болезни Крона и неспецифическом язвенном колите. Высокие количества инвазивных штаммов E.coli существуют в больших количествах в воспаленной ткани, а количество бактерий в воспаленных участках коррелирует с тяжестью воспаления кишечника. Желудочно-кишечные инфекции могут привести к развитию Т-клеток памяти, которые атакуют микробы кишечника в кишечном тракте. Пищевое отравление может вызвать иммунный ответ на микробные бактерии кишечника. Некоторые исследователи предполагают, что это может привести к воспалительным заболеваниям кишечника.
Передача патогенной кишечной палочки часто происходит фекально-оральным путем. Общие пути передачи включают в себя:. Негигиеничное приготовление пищи, фермерское загрязнение из-за навоза, орошение посевов загрязненной или грязной водой из неочищенных сточных вод, наличие одичавших свиней на пахотных землях, или прямое потребление сточных загрязненных вод. Молочный и крупный рогатый скот являются основными резервуарами кишечной палочки O157: H7, и они могут переносить его бессимптомно и распространять через свои фекалии. Пищевые продукты, связанные со вспышками E.coli, включают огурец, сырой мясной фарш, сырые ростки семян или шпинат, сырое молоко, непастеризованный сок, непастеризованный сыр и продукты, загрязненные инфицированными работниками пищевой промышленности фекально-оральным путем. В соответствии Управлением по безопасности продуктов питания и лекарственных средств США, фекально-оральный цикл передачи может быть нарушен при правильном приготовлении пищи, предотвращении перекрестного загрязнения, использовании барьеров, таких как перчатки, для пищевых работников, политика здравоохранения, обращение сотрудников пищевой промышленности за медицинской помощью, если они больны, пастеризация сока или молочных продуктов и соответствующие требования для мытья рук. Кишечная палочка, продуцирующая Шига токсин (STEC), в частности, серотип O157: H7, также передавался через мух, а также при непосредственном контакте с сельскохозяйственными животными, животными из мини-зоопарка, и частицами, распространяющимися в воздухе, в среде, где содержатся животные. 7)
Уропатогенные кишечные палочки (UPEC) являются причиной примерно 90% инфекций мочевыводящих путей (ИМП), наблюдаемых у людей с обычной анатомией. При восходящих инфекциях, фекальные бактерии колонизируют уретру и распространяются от мочевого тракта до мочевого пузыря, а также в почки (вызывая пиелонефрит), или простату у мужчин. Поскольку женщины имеют более короткий мочеиспускательный канал, чем мужчины, они в 14 раз чаще страдают от восходящих ИМП. Уропатогенные кишечные палочки используют P фимбрии (пиелонефрит-ассоциированные пили), чтобы связать уротелиальные клетки мочевых путей и колонизировать мочевой пузырь. Эти адгезины специфически связывают фрагменты D-галактоза-D-галактозы на антигене P групп крови эритроцитов и уроэпителиальных клетках. Примерно 1% населения Земли испытывает недостаток этого рецептора, и его присутствие или отсутствие опосредует восприимчивость или не восприимчивость человека к инфекции мочевых путей E.coli, соответственно. Уропатогенные кишечные палочки производят альфа- и бета-гемолизины, которые вызывают лизис клеток мочевых путей. Другим фактором вирулентности, который обычно присутствует в UPEC, является семейство Dr из адгезинов, которые особенно связаны с циститом и ассоциированным с беременностью пиелонефритом. Адгезины Dr связывают антиген Dr группы крови (DRA), который присутствует на распад ускоряющем факторе (DAF) на эритроцитах и других типах клеток. Там, Dr адгезины индуцируют развитие длинных клеточных расширений, которые обертываются вокруг бактерий, сопровождаясь активацией нескольких сигнальных каскадов, включая активацию PI-3-киназы. UPEC может обойти врожденную иммунную защиту организма (например, систему комплемента), вторгаясь в поверхностные клетки с образованием внутриклеточных бактериальных сообществ (ВБС). Кроме того, они обладают способностью к образованию K антигена, капсульных полисахаридов, которые способствуют образованию биопленки. Кишечные палочки, производящие биопленку, являются недостижимыми для иммунных факторов и антибактериальной терапии, и часто влияют на развитие хронических инфекций мочевых путей. Инфекции E.coli, производящие K антиген, обычно встречаются в верхних мочевых путях. Нисходящие инфекции возникают, хотя и сравнительно редко, когда клетки кишечной палочки входят в органы верхних мочевых путей (почки, мочевой пузырь или мочеточники) из потока крови.
Производится серотипом кишечной палочки, которая содержит капсульный антиген под названием K1. Колонизация кишечника новорожденного этими штаммами, которые присутствуют во влагалище матери, приводит к бактериемии, которая, в свою очередь, приводит к менингиту. И из-за отсутствия антител класса IgM от матери (они не пересекают плаценту, потому что FcRn опосредует только передачу IgG), к тому же, стоит учитывать также тот факт, что организм распознает антиген K1 как часть себя, поскольку он напоминает церебральные гликопептиды, и приводит к развитию серьезной степени менингита у новорожденных.
Существуют некоторые штаммы кишечной палочки, которые содержат геномный остров поликетидсинтазы (PKS), чья функция заключается в кодировании мульти-ферментативного механизма, который производит генотоксическое вещество, называемое колибактин. Колибактин может вызывать клеточное старение или рак, повреждая ДНК. Тем не менее, барьер слизистой оболочки препятствует достижению E.coli поверхности энтероцитов. Только тогда, когда совместно с инфекцией E. coli развиваются некоторые воспалительные поражения, бактерия способна вводить колибактин в энтероциты, вызывая развитие опухоли.
У животных, вирулентные штаммы E.coli вызывают различные заболевания, среди прочих – септицемия и диарея у новорожденных телят, острый мастит у молочных коров, колибактериоз также ассоциируется с хроническими респираторными заболеваниями с микоплазмой, вызывая перигепатит, перикардит, септические легкие, перитонит и т.д. у домашней птицы, и гниль Алабама у собак. Большая часть серотипов, выделенных из птицы, являются патогенными только для птиц. Таким образом, птичьи источники кишечной палочки не кажутся важными источниками инфекций у других животных.
Лабораторная диагностика
Антибактериальная терапия и резистентность
Фаготерапия – использование вирусов, которые направленно воздействуют на патогенных бактерий, была разработана в течение последних 80 лет, в основном, в странах бывшего Советского Союза, где она использовалась для предотвращения диареи, вызванной кишечной палочкой. В настоящее время, фаготерапия для людей доступна только в центре фаготерапии в Республике Грузия и в Польше. Тем не менее, 2 января 2007 года FDA Соединенных Штатов дало одобрение для компании Omnilytics на применение фага, убивающего кишечную палочку O157: H7 для живых животных, которые будут зарезаны для потребления человеком. Фага энтеробактерии Т4, широко изученная фага, направлена на кишечную палочку.
| Shigatoxigenic и веротоксин кишечной палочки | |
|---|---|
| Специальность | Инфекционное заболевание |
содержание
EHECs , которые вызывают кровавый понос приводят к ЖКУ в 10% случаев. Клинические проявления postdiarrheal HUS включают острую почечную недостаточность , микроангиопатическую гемолитическую анемию и тромбоцитопению . Verocytotoxin (Шига-подобный токсин) может непосредственно привести к повреждению почек и эндотелиальные клетки. Тромбоцитопения происходит как тромбоциты потребляется свертываемости. Гемолитические анемии Результаты из внутрисосудистого фибрина осаждения, повышенная ломкость красных кровяных клеток, и фрагментации.
Антибиотики имеют сомнительную ценность и не показали , чтобы быть четкой клинической пользы. Антибиотики , которые мешают синтез ДНК, например, фторхинолоны , как были показаны , чтобы побудить STX-бактериофаг подшипника и вызывают повышенную выработку токсинов. Попытки блокировать выработку токсина с антибактериальных , которые нацелены на рибосом синтез белка концептуально более привлекательным. Плазмаферез предлагает спорное , но , возможно , полезно лечение. Использование antimotility агентов (лекарства , которые подавляют диарею, замедляя транзит кишечника) у детей в возрасте до 10 лет или у пациентов пожилого возраста следует избегать, так как они увеличивают риск развития ГУС с EHEC инфекций.
Клиническая картина варьирует от умеренной и неосложненной диарее к геморрагического колита с сильной болью в животе. Серотип О157: Н7 может вызвать инфекционную дозу с 100 бактериальными клетками или меньше; другой штамм , такие как 104: H4 также вызвал вспышку в Германии 2011. инфекции являются наиболее распространенными в теплое время года и у детей в возрасте до пяти лет , и, как правило , получены из сырой говядины и непастеризованного молока и сока. Первоначально , не кровавый понос развивается у пациентов после бактерия прикрепляется к эпителию или терминальной подвздошной , слепой кишке и толстой кишке . Последующее производство токсинов опосредует кровавый понос. У детей, осложнение может быть гемолитической синдром уремической , который затем использует цитотоксины атаковать клетки в кишечнике, так что бактерии могут вытекать в кровь и вызвать повреждение эндотелия в местах , такие как почки , путем связывания с globotriaosylceramide (Gb3).
имена
| название | Краткая форма |
|---|---|
| Энтерогеморрагические кишечная палочка | EHEC |
| гемолитический уремический синдром , ассоциированный с Энтерогеморрагическая кишечной палочки | HUSEC |
| токсин Шига-продуцирующие E.coli , | STEC |
| shigatoxigenic кишечной палочки | STEC |
| Шига-токсин , как продуцирующие E.coli , | SLTEC |
| веротоксин-продуцирующие E.coli , | VTEC |
| веротоксин кишечной палочки | VTEC |
| verocytotoxin-продуцирующие E.coli , | VTEC |
| verocytotoxigenic кишечной палочки | VTEC |
Инфекционность и вирулентности
Инфекционность или вирулентность из штамма EHEC зависит от нескольких факторов, в том числе наличия фукозы в среде, в зондировании этого сахара и активации EHEC острова патогенность .
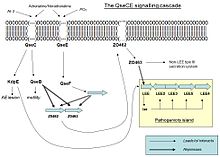
ЭГЭЦ становится патогенным посредством экспрессии локуса энтероцитов сглаживания (LEE), кодируемого на его острове патогенность. Однако, когда EHEC не в хостах это выражение является пустой тратой энергии и ресурсов, поэтому она активируется только тогда, когда некоторые молекулы ощущаются в окружающей среде.
Когда QseC или QseE связываются с одним из их взаимодействующих сигнальной молекулы, они autophosphorylate и передать его фосфат регулятора ответа. QseC чувствует адреналин , норадреналин и эндонуклеазой I-SceIII, кодируемый мобильной группы я интрона внутри гена митохондриальной COX1 (AI3); в то время как QseE чувства адреналина, норадреналина, SO4 и PO4. Эти сигналы ясно указывает на бактерии , что они больше не являются свободными в окружающей среде, но в кишечнике.
В результате QseC фосфорилирует QseB (который активирует жгутиков), KpdE (который активирует LEE) и QseF. QseE фосфорилирует QseF. Продукты QseBC и QseEF подавляют экспрессию FusK и FusR. FusK и FusR являются два компонента системы для подавления транскрипции генов LEE. FusK представляет собой датчик киназы, который способен ощущать много сахаров, среди которых фукоза. Когда фукоз присутствует в среде FusK фосфорилирует FusR, который подавляет экспрессию LEE.
Таким образом, когда ЭГЭЦ входит в кишечнике существует конкуренция между сигналами, поступающими от QseC и QseF, и сигнала, поступающего от FusK. Первые два хотели бы, чтобы активировать вирулентность, но Fusk останавливает его, потому что слизистый слой, который является источником фукозов, изолирует энтероциты от бактерий делают синтез факторы вирулентности бесполезно. Однако, когда концентрация фукозы уменьшается, так как бактериальные клетки находят незащищенную область эпителия, то экспрессия генов LEE не будет подавлена FusR и KpdE будет сильно активировать их. Таким образом, комбинированный эффект QseC / QseF и FusKR обеспечивает тонкую настройку систему экспрессии LEE, которое экономит энергию и позволяют механизмы вирулентности быть выражены только тогда, когда шансы на успех выше.
комплекс FusKR

Фукоза увеличивает активацию системы FusKR, который ингибирует ген z0461, который контролирует метаболизм фукозы. Это является механизм , который полезен , чтобы избежать конкуренции за фукозы с другими штаммами кишечной палочки , которые обычно более эффективны при использовании фукозу в качестве источника углерода. Высокие концентрации фукозов в среде также увеличивает подавление подветренных генов.

С низким уровнем фукозов в окружающей среде, система FusKR неактивна, и это означает, что z0461 ген транскрибируется, таким образом, увеличивая метаболизм фукозы. Кроме того, низкая концентрация фукозы является показателем незащищенного эпителия, таким образом, подавление генов Леров исчезнет, и экспрессия генов LEE позволит атаковать соседние клетки.
Читайте также:


