Антигены бактерий по локализации подразделяют на капсульные, соматические, жгутиковые и антигены экзопродуктов (рис. 9.6).

Рис. 9.Б. Схема расположения антигенов у бактерии:
К — капсульный, 1 — вирулентности, Н — жгутиковый, 0 — соматический
Капсульные антигены, или К-антигены, являются самыми внешними постоянными структурами поверхности микробной клетки. По химическому строению их идентифицируют в основном как полисахариды, хотя прежнее подразделение К-антигенов эшерихий на Ь- и В-термолабильные антигены допускало и белковую природу этих структур. Их основу у пневмококков составляют повторяющиеся сахара: Э-глюкоза, О-галактоза и Ь-рамноза.
В антигенном отношении капсульные полисахариды неоднородны. У пневмонийных стрептококков, например, различают более 80 серологических вариантов (сероваров), что широко используется в диагностической и лечебно-профилактической работе. К более однородным К-антигенам полисахаридной природы относят Уьанти- гены энтеробактерий, бруцелл, франциселл; полисахарид-белковой природы — У-У-антигены иерсиний; белковой природы — М-про- теин стрептококков группы А, протеин А стафилококков, антигены К-88 и К-99 эшерихий.
Из других внешних структур, обладающих антигенными свойствами, можно назвать корд-фактор микобактерий, полипептидные капсулы сибиреязвенного микроба, но их из-за непостоянства не относят к капсульным антигенам.
Соматические антигены, или О-антигены, представляют собой боковые олигосахаридные цепи липополисахаридов (эндотоксина), выступающие над поверхностью клеточной стенки грамотрицательных бактерий. Концевые углеводные остатки в боковых олигосахаридных цепях могут различаться как порядком расположения углеводов в оли- госахаридной цепи, так и стерически. Фактически они и являются антигенными детерминантами. У сальмонелл насчитывают около 40 таких детерминант, до четырех на поверхности одной клетки. По их общности сальмонелл объединяют в О-группы. Однако специфичность О- антигена сальмонелл связана с дидезоксигексозами, в числе которых выявлены паратоза, колитоза, абеквоза, тивелоза, аскарилоза и др. Уникальные концевые углеводные остатки, которые входят в структуру олигосахарида, являются наиболее удаленными от поверхности клетки и непосредственно связываются с активными центрами антител.
Наружная полисахаридная часть О-антигена (точнее, эндотоксина) ответственна за антигенные связи энтеробактерий, т.е. за неспецифические серологические реакции, с помощью которых может быть выявлен не только вид, но и штамм энтеробактерии.
О-антигены были названы соматическими, когда их точная локализация еще не была известна. Фактически же и К- и О-антигены являются поверхностными, разница состоит в том, что К-антиген экранирует О-антиген. Отсюда следует: прежде чем выявить О-анти- ген, необходимо взвесь исследуемых бактерий подвергнуть температурной обработке.
Жгутиковые антигены, или Н-антигены, имеют все подвижные бактерии. Эти антигены представляют собой термолабильные белковые комплексы жгутиков, которыми обладают многие энтеробактерии. Таким образом, энтеробактерии обладают двумя наборами антигенных детерминант — штаммоспецифической (О-антиген) и группоспецифической (Н-антиген и К-антиген).
Полная антигенная формула грамотрицательных бактерий записывается в последовательности О: Н : К. Антигены при этом являются наиболее стабильными маркерами определенных возбудителей, благодаря чему удается сделать серьезный эпизоотологический или эпидемиологический анализ.
Антигенными свойствами обладают также бактериальные споры. Они содержат антиген, общий для вегетативной клетки, и собственно споровый антиген.
Таким образом, постоянные, временные структуры и формы бактерий, а также их метаболиты обладают самостоятельными антигенными свойствами, характерными, однако, для определенных видов микроорганизмов. Поскольку все они являются маркерами особого строения ДНК у данного вида бактерий, часто на поверхности микробной клетки и в ее метаболитах содержатся общие антигенные детерминанты.
Последний факт имеет важное значение для совершенствования способов идентификации микроорганизмов. Так, например, вместо трудоемкой, дорогостоящей и не всегда воспроизводимой реакции нейтрализации для определения сероваров ботулинического микроба можно применять экспресс-метод, основанный на выявлении поверхностных детерминант при помощи иммунофлуоресценции.
В отличие от антигенов другого происхождения среди бактериальных антигенов выделяют так называемые протективные, или защитные, антигены. Выработанные на эти антигены антитела защищают организм отданного патогенного микроорганизма. Протективными свойствами обладают капсульные антигены пневмококков, М-проте- ин стрептококков, А-протеин стафилококков, белок второй фракции экзотоксина сибиреязвенных бацилл, белковые молекулы нижних слоев стенки некоторых грамотрицательных бактерий и др. Очищенные протективные антигены не обладают пирогенными, аллергенными свойствами, хорошо сохраняются и поэтому приближаются к идеальным вакцинным препаратам.
Протективные антигены обусловливают иммуногенность микробных антигенов. Антигены не всех микроорганизмов способны создавать одинаково выраженный иммунитет. Для повышения имму- ногенности в ряде случаев антиген смешивают с адъювантами — неспецифическими стимуляторами иммуногенеза минеральной или органической природы. Чаще с этой целью используют гидроокись алюминия, алюминиево-калиевые квасцы, ланолин, вазелиновое масло, липополисахарид бактерий, препараты бордетелл и др. Наиболее популярным у исследователей является адъювант Фрейнда, состоящий из вазелинового масла, ланолина (неполный адъювант) и микобактерий туберкулезной палочки (полный адъювант). Прививка людей инактивированными вакцинами против гриппа и полиомиелита с неполным адъювантом Фрейнда подтвердила их эффективность. Аналогичные адъюванты с успехом использовали для усиления иммуногенности вирусных вакцин против ящура, парагриппа типа 3, болезни Ауески, чумы плотоядных, инфекционного гепатита собак, болезни Гамборо, ньюкаслской болезни, гриппа лошадей, ро- тавирусной диареи телят и других болезней. Такие вакцины вызывают выраженный и продолжительный иммунный ответ. Благодаря этому значительно повышается эффективность вакцинации и сокращается количество ежегодных прививок. Каждый адъювант вводится в организм согласно прилагаемой к нему инструкции: подкожно, внутримышечно, внутрибрюшинно и т.д.
Сущность адъювантного действия названных препаратов заключается в сдерживании поступления смешанного с ними антигена в организм, что пролонгирует его иммунизирующее действие, снижает реактогенность, а в некоторых случаях вызывает бласт-трансформа- цию (рис. 9.7).

Рис. 9.7. Сдерживающее воздействие адъюванта на распространение антигена
Большинство адъювантов способны депонировать антиген, т.е. адсорбировать его на своей поверхности и длительное время сохранять в организме, что увеличивает продолжительность его влияния на иммунную систему. Однако при изготовлении антисыворотки для им- мунохимического анализа, особенно в целях установления природы антигенов или антигенных связей, избегают использования микробных адъювантов, поскольку они снижают специфичность антисыворотки. Происходит это за счет гетерогенности (или гетерофильнос- ти) антигенов, т.е. антигенной общности микробов различных таксономических групп, тканей растений, животных и человека.
Генетически чужеродные вещества, которые при внедрении в организм способны стимулировать иммунный ответ (клеточную реакцию, образование антител, аллергию, толерантность) и специфически реагировать с образовавшимися антителами как in vivo, так in vitro, называют антигенами.
Антиген должен быть чужеродным веществом для данного вида животного, иначе образование им специфи- ческих антител не произойдет. При определенных условиях (мутации, различные повреждающие действия) чужеродными могут стать и собственные клетки организма. Антиген вызывает в организме образование антител и реагирует с образовавшимися антителами как в живом организме, так и в пробирке. Антигенами могут быть белки, полисахариды, полипептиды, липополисахариды или нуклеиновые кислоты, клетки другого организма, микробы и продукты их жизнедеятельности.
Полноценные антигены вызывают в организме синтез антител или сенсибилизацию лимфоцитов и вступают с ними в реакцию как in vivo, так и in vitro. Для полноценных антигенов характерна строгая специфичность, т. е. вызывают в организме выработку только специфических антител, вступающих в реакцию только с данным антигеном. К таким антигенам относят белки животного, растительного и бактериального происхождения.
| Неполноценные антигены (гаптены) |
Неполноценные антигены (гаптены)представляют собой сложные углеводы, липиды и другие вещества, не способные вызывать образование антител, но вступающие с ними в специфическую реакцию. Гаптены приобретают свойства полноценных антигенов лишь при условии введения их в организм в комплексе с белком.
Типичными представителями гаптенов являются липиды, полисахариды, нуклеиновые кислоты, а также простые вещества: краски, амины, йод, бром и др.
Конъюгированные антигены- белки, которые приобрели новую антигенную специфичность благодаря присоединению к ним с помощью химической связи новой химической группировки.
Аутоантигены. Иногда белки собственных тканей (сердца, печени, почек и др.) при соединении с бактериальным белком, токсинами и ферментами бактерий, лекарственными веществами, под влиянием физических факторов (облучение, ожог и др.) изменяют свои физико-химические свойства и становятся чужеродными для собственного организма. На эти антигены организм вырабатывает антитела, возникают аутоиммунные болезни.
Антигены бактерий по локализации подразделяют на капсульные (К), соматические (О), жгутиковые (Н) и антигены экзопродуктов. В свою очередь К - антигены разделяют на (L, В) термолабильные и (А, М) термостабильные антигены.
Капсульные антигены представлены белками, полисахаридами
Соматические антигены. Расположены не только в цитоплазме, а в основном на поверхности микробной клетки, имеют разнообразный химический состав, отличаются термостабильностю. В практике для обнаружения 0-антигенов микроорганизмы подвергают температурной обработке.
Жгутиковые антигены. Представляют собой термолабильные белковые комплексы жгутиков, обладающих у многих энтеробактерий специфической и неспецифической (групповой) фазой.
Антигены экзопродуктов. Включают метаболиты бактериальной клетки, среди которых наиболее полно изучены экзотоксины.
Все типы антигенов у многих видов патогенных микробов отличаются неоднородностью. На этом основании их подразделяют на варианты обозначаемые цифрами или буквами. Полная антигенная формула включает все обнаруженные у данного штамма микроорганизма варианты антигенов. Например, у кишечной палочки может быть такая антигенная формула: 0 17: К 6: Н 5.
Среди бактериальных антигенов выделяют так называемые протективные или антигены главного действия, защитные антигены. Выработанные на них антитела защищают организм от данного микроба. Очищенные протективные антигены могут быть "идеальными" вакцинными препаратами.
Антигены обладают детерминантами-участками молекул, определяющими специфичность реакции антиген-антитело. Это концевые структуры антигена, имеющие сравнительно небольшие размеры (5-7 аминокислот).
Существуют следующие разновидности бактериальных антигенов: группоспецифические (встречаются у разных видов одного рода или семейства); видоспецифические (встречаются у различных представителей одного вида); типоспецифические (определяют серологические варианты – серовары).
В зависимости от локализации в бактериальной клетке различают:
1) жгутиковые Н-АГ, локализуются в жгутиках у бактерий, основа его белок флагеллин, термолабилен;
2) соматический О-АГ связан с клеточной стенкой бактерий. Его основу составляют ЛПС, по нему различают сероварианты бактерий одного вида. Он термостабилен, не разрушается при длительном кипячении, химически устойчив (выдерживает обработку формалином и этанолом);
3) капсульные К-АГ располагаются на поверхности клеточной стенки. По чувствительности к нагреванию различают 3 типа К-АГ: А, В, L. Наибольшая термостабильность характерна для типа А, тип В выдерживает нагревание до 60 0 С в течение 1 часа, тип L быстро разрушается при этой температуре. На поверхности возбудителя брюшного тифа и др.энтеробактерий, которые обладают высокой вирулентностью можно обнаружить особый вариант капсульного АГ –Vi-антиген;
4) антигенными свойствами обладают также бактериальные белковые токсины, ферменты и некоторые др. белки.
Антигены вирусов:
1) суперкапсидные АГ – поверхностные оболочечные;
2) белковые и гликопротеидные АГ;
3) капсидные – оболочечные;
4) нуклеопротеидные (сердцевидные) АГ.
Существует 5 классов иммуноглобулинов у человека:
1) иммуноглобулин класса G – это мономер, включающий в себя 4 субкласса (IgG1, IgG2, IgG3, IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам, имеет 2 антигенсвязывающих центра. На долю его приходится 70-80% всех сывороточных Ig. Период полураспада 21 день. К основным свойствам IgG относятся: играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях; проникает через плаценту и формирует антиинфекционный иммунитет у новорожденных; способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе. IgG4 участвует в развитии аллергической реакции 1 типа.
2) иммуноглобулин класса М – пентамер, который имеет 10 антигенсвязывающих центров. Период полураспада 5 дней. На его долю приходится около 5-10% всех сывороточных Ig. Образуется в начале первичного иммунного ответа, также первым начинает синтезироваться в организме новорожденного – определяется уже на 20-й неделе внутриутробного развития. Свойства: не проникает через плаценту; появляется у плода и участвует в антиинфекционной защите; способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент; играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза; образуются на ранних сроках инфекционного процесса; отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий.
3) иммуноглобулин класса А –существует в сывороточной и секреторной формах. На долю сывороточного Ig приходится 10-15%, мономер, имеет 2 антигенсвязывающих центра, период полураспада 6 дней. Секреторный Ig существует в полимерной форме. Содержатся в молоке, молозиве, слюне, слезном, бронхиальном, желудочно-кишечном секрете, желчи, моче; участвуют в местном иммунитете, препятствуют прикреплению бактерий к слизистой, нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент.
4) иммуноглобулин класса Е-мономеры, на долю которых приходится 0,002%. К этому классу относится основная масса аллергических антител – реагинов. Уровень IgЕ значительно повышается у людей, страдающих аллергией и зараженных гельминтами.
5) иммуноглобулин класса Д –это мономер, на долю которого приходится 0,2%. Плазматические клетки, секретирующие IgД локализуются преимущественно в миндалинах и аденоидной ткани. Участвует в развитии местного иммунитета, обладает антивирусной активностью, в редких случаях активирует комплемент, участвует в дифференцеровке В-клеток, способствуют развитию антиидиотипического ответа, участвует в аутоиммунных процессах.
Способность синтезировать АТ макроорганизм приобретает довольно рано. Уже на 13 неделе эмбрионального периода развития возникают В-лимфоциты, синтезирующие IgМ, а на 20 неделе этот Ig можно определить в сыворотке крови. Концентрация антител достигает максимума к периоду полового созревания и сохраняется на высоких цифрах в течение всего репродуктивного периода. В старческом возрасте содержание антител снижается. Повышение количества Ig наблюдается при инфекционных заболеваниях, аутоиммунных расстройствах, снижение его отмечено при некоторых опухолях и иммунодефицитных состояниях. Антителопродукция в ответ на антигенный стимул имеет характерную динамику. Выделяют латентную, логарифмическую, стационарную фазы и фазу снижения. В латентную фазу антителопродукция практически не изменяется и остается на базальном уровне. Во время логарифмической фазы наблюдается интенсивный прирост количества антиген-специфичных В-лимфоцитов и происходит нарастание титра АТ. В стационарной фазе количество специфических антител и синтезирующих их клеток достигает максимума и стабилизируется. В фазе снижения наблюдается постепенное уменьшение титров антител. При первичном контакте с антигеном развивается первичный иммунный ответ. Для него характерны длительная латентная (3-5 суток) и логарифмическая (7-15 суток) фазы. Первые диагностически значимые титры антител регистрируются на 10-14-е сутки от момента иммунизации. Стационарная фаза продолжается 15-30 суток, а фаза снижения – 1-6 месяцев. В итоге первичного иммунного реагирования формируются многочисленные клоны антигенспецифичных В-лимфоцитов: антителопродуцирующих клеток и В-лимфоцитов иммунологической памяти, а во внутренней среде макроорганизма в высоком титре накапливаются IgG и/или IgА (а также IgЕ). Со временем антительный ответ угасает. Повторный контакт иммунной системы с тем же антигеном ведет к формированию вторичного иммунного ответа. Для вторичного ответа характерна укороченная латентная фаза (от нескольких часов до 1-2 суток). Логарифмическая фаза отличается более интенсивной динамикой прироста и более высокими титрами специфических антител. При вторичном иммунном ответе организм сразу же, в подавляющем большинстве синтезирует IgG. Характерная динамика антителопродукции обусловлена подготовленностью иммунной системы к повторной встрече с антигеном за счет формирования иммунологической памяти.
Явление интенсивного антителообразования при повторном контакте с антигеном широко используется в практических целях, например при вакцинопрофилактике. Для создания и поддержания иммунитета на высоком защитном уровне схемы вакцинации предусматривают первичное введение антигена для формирования иммунологической памяти и последующие ревакцинации через различные интервалы времени.
Этот же феномен используют при получении высокоактивных лечебных и диагностических иммунных сывороток (гипериммунных). Для этого животным или донорам производят многократные введения препаратов антигена по специальной схеме.
Иммунный статус – это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей.
На иммунный статус оказывают влияние следующие факторы: 1) климато-географические (температура, влажность, солнечная радиация, длина светового дня); 2) социальные (питание, жилищно-бытовые условия, профессиональные вредности); 3) экологические (загрязнение окружающей среды радиоактивными веществами, применение пестицидов в сельском хозяйстве); 4) влияние диагностических и лечебных манипуляций, лекарственная терапия; 5) стресс.
Иммунный статус можно определить путем постановки комплекса лабораторных тестов, включающих оценку состояния факторов неспецифической резистентности, гуморального (В) и клеточного (Т) иммунитета. Оценка иммунного статуса проводится в клинике при трансплантации органов и тканей, аутоиммунных заболеваниях, аллергиях, для контроля эффективности лечения болезней, связанных с нарушением иммунной системы. Оценка иммунного статуса чаще всего базируется на определении следующих показателей:
1) общего клинического обследования (жалобы больного, профессия, осмотр);
2) состояния факторов естественной резистентности (определяют фагоцитоз, комплемент, интерфероновый статус, колонизационную резистентность);
3) гуморального иммунитета (определение иммуноглобулинов класса G, М, А, Д, Е в сыворотке крови);
4) клеточного иммунитета (оценивается по количеству Т-лимфоцитов – реакция розеткообразования, определение соотношения хелперов и супрессоров Т4 и Т8 лимфоцитов, которое в норме составляет примерно 2);
5) дополнительных тестов (определение бактерицидности сыворотки крови, титрование С3, С4 компонентов комплемента, определение содержания С-реактивного белка в сыворотке крови, определение ревматоидных факторов.
| Рекомендуем: |
|
| Микробиология: |
| Микробиология |
| Общая микробиология |
| Общая бактериология |
| Экология микробов |
| Учение об инфекции |
| Лечение инфекций |
| Иммунология |
| Методы диагностики |
| Грам "+" бактерии |
| Грам "-" бактерии |
| Микобактерии |
| Хламидии. Риккетсии |
| Спирохеты. Трепонемы |
| Вирусы |
| Грибы |
| Простейшие |
| Гельминтозы |
| Санитарная микробиология |
| Видео по микробиологии |
| Книги по микробиологии |
| Форум |
Оглавление темы "Эшерихии. Эшерихиозы. Кишечная палочка. Шигеллы. Дизентерия.":
1. Диагностика энтеробактерий. Выявление энтеробактерий. Диагностические подходы для энтеробактерий.
2. Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
3. Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.
4. Патогенез поражений кишечной палочкой. Клинические проявления коли инфекции. Кишечные инфекции ( коли-инфекции ). Энтеротоксигенные кишечные палочки.
5. Энтероинвазивные кишечные палочки. Энтеропатогенные эшерихии. Энтерогеморрагические кишечные палочки.
6. Энтероадгезивные кишечные палочки. Уропатогенные эшерихии. Инфекции мочевыводящих путей вызванные кишечной палочкой. Бактериемия эшерихий.
7. Менингит вызванный кишечной палочкой. Респираторные инфекции вызванные эшерихиями ( кишечной палочкой ).
8. Микробиологическая диагностика кишечной палочки. Диагностика кишечной палочки. Выявление эшерихий.
9. Лечение эшерихиозов. Лечение кишечной инфекции. Профилактика эшерихиозов. Профилактика кишечной инфекции.
10. Шигеллы. Дизентерия. Бактериальная дизентерия. Шигеллез. История дизентерии. Серовары шигелл. Серовары возбудителей дизентерии.
Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.
Биохимические свойства кишечной палочки представлены в табл. 18-1. По способности кишечной палочки ферментировать лактозу разделяют лактоза-отрицательные и лактоза-положительные. Бактерии образуют индол, восстанавливают нитраты и декарбоксилируют лизин.
Таблица 18-1. Основные биохимические признаки бактерий семейства Enterobactenaceae, имеющих медицинское значение 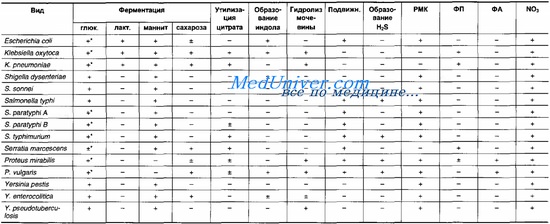
Таблица 18-2. Серовары кишечной палочки, наиболее часто вызывающие поражения у человека 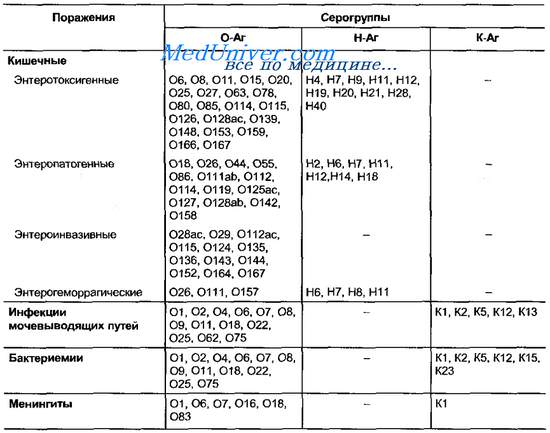
Поскольку морфологического различия между патогенными и непатогенными кишечными палочками нет, их дифферепцировка основана на различиях в структуре антигенов.
У Е. coli выделяют липополисахаридные (О), жгутиковые белковые (Н-), капсульные полисахаридные (К) Аг, обозначаемые арабскими цифрами. На практике обычно используют соотношение О:Н (в настоящее время выделено 173 0- и 56 Н-ссроваров).
Наиболее информативное исследование — типирование по О-Аг (табл. 18-2).
По К-Аг бактерии кишечной палочки разделяют на три группы (L, В и А); по их структуре выделяют 80 сероваров.
Антигенная структура микроорганизмов очень разнообразна. У микроорганизмов различают общие, или групповые, и специфические, или типовые, антигены.
Групповые антигены являются общими для двух или более видов микробов, входящих в один род, а иногда относящихся и к разным родам. Так, общие групповые антигены имеются у отдельных типов рода сальмонелл; возбудители брюшного тифа имеют общие групповые антигены с возбудителями паратифа А и паратифа В (0—1,12).
Специфические антигены имеются только у данного вида микроба или даже только у определенного типа (варианта) либо подтипа внутри вида. Определение специфических антигенов позволяет дифференцировать микробы внутри рода, вида, подвида и даже типа (подтипа). Так, внутри рода сальмонелл по комбинации антигенов дифференцировано более 2000 типов сальмонелл, а у подвида шигелл Флекснера — 5 серотипов (серовариантов).
По локализации антигенов в микробной клетке различают соматические антигены, связанные с телом микробной клетки, капсульные — поверхностные, или оболочечные антигены и жгутиковые антигены, находящиеся в жгутиках.
Соматические, О-антигены (от нем. ohne Hauch — без дыхания), связаны с телом микробной клетки. У грамотрицательных бактерий О-антиген — сложный комплекс липидополисахаридно-белковой природы. Он высоко токсичен и является эндотоксином этих бактерий. У возбудителей кокковых инфекций, холерных вибрионов, возбудителей бруцеллеза, туберкулеза и некоторых анаэробов из тела микробных клеток выделены полисахаридные антигены, которые обусловливают типовую специфичность бактерий. Как антигены они могут быть активны в чистом виде и в комплексе с липидами.
Жгутиковые, Н-антигены (от нем. Hauch — дыхание), имеют белковую природу и находятся в жгутиках подвижных микробов. Жгутиковые антигены быстро разрушаются при нагревании и под действием фенола. Они хорошо сохраняются в присутствии формалина. Это свойство используют при изготовлении убитых диагностии кумов для реакции агглютинации, когда необходимо сохранить жгутики.
Капсульные, К - антигены, - расположены на поверхности микробной клетки и называются еще поверхностными, или оболочечными. Наиболее детально они изучены у микробов семейства кишечных, у которых различают Vi-, М-, В-, L- и А-антигены. Важное значение из них имеет Vi-антиген. Впервые он был обнаружен в штаммах бактерий брюшного тифа, обладающих высокой вирулентностью, и получил название антигена вирулентности. При иммунизации человека комплексом О- и Vi- антигенов наблюдается высокая степень защиты против брюшного тифа. Vi-антиген разрушается при 60°С и менее токсичен, чем О-антиген. Он обнаружен и у других кишечных микробов, например у кишечной палочки.
Протективный (от лат. protectio — покровительство, защита), или защитный, антиген образуется сибиреязвенными микробами в организме животных и обнаруживается в различных экссудатах при заболевании сибирской язвой. Протективный антиген является частью экзотоксина, выделяемого микробом сибирской язвы, и способен вызывать выработку иммунитета. В ответ на введение этого антигена образуются комплементсвязывающие антитела. Протективный антиген можно получить при выращивании сибиреязвенного микроба на сложной синтетической среде. Из протективного антигена приготовлена высокоэффективная химическая вакцина против сибирской язвы. Защитные протективные антигены обнаружены также у возбудителей чумы, бруцеллеза, туляремии, коклюша.
Полноценные антигены вызывают в организме синтез антител или сенсибилизацию лимфоцитов и вступают с ними в реакцию как in vivo, так и in vitro. Для полноценных антигенов характерна строгая специфичность, т. е. вызывают в организме выработку только специфических антител, вступающих в реакцию только с данным антигеном. К таким антигенам относят белки животного, растительного и бактериального происхождения.
Неполноценные антигены (гаптены) представляют собой сложные углеводы, липиды и другие вещества, не способные вызывать образование антител, но вступающие с ними в специфическую реакцию. Гаптены приобретают свойства полноценных антигенов лишь при условии введения их в организм в комплексе с белком.
Типичными представителями гаптенов являются липиды, полисахариды, нуклеиновые кислоты, а также простые вещества: краски, амины, йод, бром и др.
49. Антителообразование. Первичный и вторичный ответ.
Антителообразование - образование специфических иммуноглобулинов, индуцированное антигеном; происходит гл. обр. в зрелых плазматических клетках, а также в плазмобластах и лимфобластах.
Первичный иммунный ответ наблюдается при первичном введении антигена в организм. Он характеризуется довольно медленным нарастанием количества антителопродуцирующих плазматических клеток, синтезом иммуноглобулинов и их поступлением в кровь. Максимальное количество антител в сыворотке крови отмечается к 7-8-му дню и сохраняется на данном уровне в течение 2 нед, затем начинает постепенно уменьшаться. Через 2—3 мес антитела обнаруживаются в очень небольшом количестве.
Вторичный иммунный ответ проявляется через 4—5 дней после повторного введения того же антигена. При этом количество антител не менее чем в 3 раза больше, чем при первичном ответе. Вторичный иммунный ответ можно наблюдать через многие месяцы и даже годы после первого введения антигена и формирования иммунологической памяти. Установленные закономерности легли в основу современных методов вакцинации людей, т. е. повторной вакцинации через определенное время.
50. Учение об аллергии и анафилаксии.
Аллергия (иммунология. ) - состояние измененной повышенной чувствительности организма к различным чужеродным веществам, в том числе и к микробам, — аллергию.
Реакции повышенной чувствительности делятся на две группы: реакции немедленного и замедленного типов, или соответственно ранние и поздние. К реакциям немедленного типа относят анафилаксию, феномен Артюса (местная анафилаксия) и атопии, к повышенной чувствительности замедленного типа — инфекционную аллергию и контактные дерматиты. Существуют также аллергические реакции смешанного типа; лекарственная аллергия и сывороточная болезнь.
Аллергены - вещества, которые при введении вызывают повышение чувствительности. Это полноценные антигены (чужеродные белки, лечебные сыворотки, антигены микробов) и гаптены, которые становятся аллергенами при соединении их с белками организма.
Пути проникновения аллергенов в организм могут быть различными: парентерально вводят медикаменты, лечебные сыворотки, иммуноглобулины, через рот (перорально) —пищевые и лекарственные вещества; при вдыхании (ингаляционно) в организм попадают пыль, пыльца растений, эфирные масла, различные пахучие вещества; через кожу проникают контактно-лекарственные и химические вещества.
Анафилаксия — состояние повышенной чувствительности к повторному введению чужеродного белка или аналогичого ему по сенсибилизирующим свойствам антигена. Вещества, которые вызывают анафилаксию, называют анафилактогенами. Это полноценные антигены: белки животного или растительного происхождения, бактериальные токсины, а также полисахариды, полученные из пневмококков, стрептококков и микобактерий. Большинство гаптенов становится анафилактогенами лишь при соединении их с белками организма. Первичное введение анафилактогена называется сенсибилизирующим (отфран. sensibiliser — делать чувствительным), а повторное, при котором возникает анафилактический шок, разрешающим. Сенсибилизация обычно наступает при парентеральном введении антигена: подкожном, внутрикожном и внутривенном. Однако возможна сенсибилизация и в случае поступления антигена через легкие и кишечник при быстром всасывании. При повторном введении в сенсибилизированный организм анафилактогена возникает быстрая, бурная ответная реакция — анафилактический шок, который может закончиться смертью. Анафилактическая реакция строго специфична и возникает только при повторной инъекции сенсибилизирующего антигена.
51. Гиперчувствительность. Ее типы. Механизмы возникновения, клиническая значимость.
При инфекционной патологии связывание Аг AT обеспечивает пониженную чувствительность к действию различных микроорганизмов и их токсинов. Повторный контакт с Аг вызывает развитие вторичного ответа, протекающего намного интенсивнее. Аг не всегда стимулируют выработку AT, понижающих чувствительность к ним. В определённых условиях вырабатываются AT, взаимодействие которых с Аг повышает чувствительность организма к его повторному проникновению (реакции гиперчувствительности).
Гиперчувствительность немедленного типа (ГНТ) - гиперчувствительность, обусловленная антителами (IgE, IgG, IgM) против аллергенов. Развивается через несколько минут или часов после воздействия аллергена: расширяются сосуды, повышается их проницаемость, развиваются зуд, бронхоспазм, сыпь, отеки. Поздняя фаза ГНТ дополняется действием продуктов эозинофилов и нейтрофилов.
К ГНТ относятся I, II и III типы аллергических реакций (по Джеллу и Кумбсу): I тип - анафилактический, обусловленный гл. обр. действием IgE; II тип - цитотоксический, обусловленный действием , IgG, IgM; III тип - иммунокомплексный, развивающийся при образовании иммунного комплекса IgG, IgM с антигенами. В отдельный тип выделяют антирецепторные реакции.
Гиперчувствительность замедленного типа (ГЗТ) - относится к IV типу аллергии (по Джеллу и Кумбсу). Она обусловлена взаимодействием антигена (аллергена) с макрофагами и Thl-лимфоцитами, стимулирущими клеточный иммунитет. Развивается гл. обр. через 1-3 суток после воздействия аллергена: происходит уплотнение и воспаление ткани, в результате ее инфильтрации Т-лимфоцитами и макрофагами.
52. Оценка иммунного статуса макроорганизма: основные показатели и методы определения.
Иммунный статус — это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей.
Таким образом, иммунный статус характеризует способность к иммунному ответу на определенный антиген в данный момент времени.
На иммунный статус оказывают влияние следующие факторы:
• экологические (физические, химические и биологические);
Оценка иммунного статуса проводится в клинике при трансплантации органов и тканей, аутоиммунных заболеваниях, аллергиях, для выявления иммунологической недостаточности при различных инфекционных и соматических заболеваниях, для контроля эффективности лечения болезней, связанных с нарушениями иммунной системы.
Существуют скрининговые тесты оценки иммунного статуса, которые позволяют быстро оценить основные показатели работы иммунной системы.
Стандартный скрининговый тест включает:
1. Подсчет абсолютного количества лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов.
2. Определение концентрации сывороточных иммуноглобулинов различных классов (IgG, IgA и IgM)
3. Определение гемолитической активности системы комплемента CH50.
4. Проведение кожных тестов гиперчувствительности замедленного типа.
Более детальное изучение иммунного статуса включает изучение количества и функциональной активности клеточного и гуморального звеньев иммунной системы:
1. Исследование фагоцитарной функции.
2. Исследование системы комплемента.
3. Исследование Т-системы иммунитета.
4. Исследование В-системы иммунитета.
53-59. Реакции агглютинации (найдете в методичке)
60. Особенности противовирусного иммунитета.
61. Вакцины, определение, классификация, применение.
Вакцина — медицинский препарат, предназначенный для создания иммунитета к инфекционным болезням.
1. Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Примером таких вакцин являются БЦЖ и вакцина против натуральной оспы человека
2. Инактивированные (убитые) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). В препараты иногда добавляют консерванты и адьюванты.
3. Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант.
4. Корпускулярные вакцины – содержащие в своем составе протективный антиген
5. Анатоксины относятся к числу наиболее эффективных препаратов. Принцип получения – токсин соответствующей бактерии в молекулярном виде превращают в нетоксичную, но сохранившую свою антигенную специфичность форму путем воздействия 0.4% формальдегида при 37t в течение 3-4 недель, далее анатоксин концентрируют, очищают, добавляют адьюванты.
6. Синтетические вакцины. Молекулы эпитопов сами по себе не обладают высокой иммуногенностью для повышения их антигенных свойств эти молекулы сшиваются с полимерным крупномолекулярным безвредным веществом, иногда добавляют адьюванты.
7. Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов.
62. Анатоксины. Получение применение.
Анатоксины – препараты, полученные из бактериальных экзотоксинов, полностью лишенные своих токсических свойств, но сохранившие антигенные и иммуногенные свойства. Получение: токсигенные бактерии выращивают на жидких средах, фильтруют с помощью бактериальных фильтров для удаления микробных тел, к фильтрату добавляют 0,4% формалина и выдерживают в термостате при 30-40t на 4 недели до полного исчезновения токсических свойств, проверяют на стерильность, токсигенность и иммуногенность. Эти препараты называются нативными анатоксинам, в настоящее время почти не используются, т. к. содержат большое количество балластных веществ, неблагоприятно влияющих на организм. Анатоксины подвергают физической и химической очистке, адсорбируют на адъювантах. Такие препараты называются адсорбированными высокоочищенными концентрированными анатоксинами.
Титрование анатоксинов в реакции фолликуляции производят по стандартной фолликулирующей антитоксической сыворотке, в которой известно количество антитоксических единиц. 1 антигенная единица анатоксина обозначается Lf, это то количество анатоксина, которое вступает в реакцию фолликуляции с 1 единицей дифтерийного анатоксина.
Анатоксины применяются для профилактики и реже, для лечения токсинемических инфекций (дифтерия, газовая гангрена, ботулизм, столбняк). Так же анатоксины применяются для получения антитоксических сывороток путем гипериммунизации животных.
Примеры препаратов: АКДС, АДС, адсорбированный стафилококковый анатоксин, ботулинистический анатоксин, анатоксины из экзотоксинов возбудителей газовых инфекций.
63. Серотерапия инфекционных заболеваний. Антитоксические сыворотки. Препараты иммуноглобулинов.
Серологические методы исследования широко применяют для диагностики практически всех инфекционных заболеваний. Эти методы просты, чувствительны и доступны для практических лабораторий. Однако существенным недостатком серологической диагностики является ее ретроспективный характер, так как для точного подтверждения диагноза необходимо установить нарастание титра специфических антител в динамике заболевания, для чего первую сыворотку обычно берут в начале болезни, а вторую - через 7-14 дней и позже. Исключение составляет ИФА, с помощью которого можно раздельно определять антитела классов IgM и IgG. Обнаружение в сыворотке крови антител класса IgM указывает на активно текущую инфекцию, тогда как выявление антител класса IgG свидетельствует о прошедшем заболевании.
Серотерапия - лечение сыворотками иммунизированных животных или иммунных людей. Лечебные сыворотки могут быть антитоксическими и антибактериальными. Антитоксические сыворотки получают путем иммунизации лошадей соответствующим токсином или анатоксином, в результате чего в их крови образуется специфический антитоксин. Специфические антитоксические сыворотки применяются для лечения больных дифтерией, столбняком, ботулизмом и газовой гангреной.
При раннем введении антитоксические сыворотки весьма эффективны. Они нейтрализуют только токсин, свободно циркулирующий в крови. Дозу сыворотки выражают в антитоксических единицах (АЕ).
К серотерапии относится и применение иммуноглобулинов, приготовленных из нормальной сыворотки человека или из сыворотки предварительно иммунизированных людей (иммуноглобулин человека нормальный). Препарат применяют для профилактики кори, гриппа, коклюша, гепатита А, менингококковой инфекции и др. Кроме того, используются противостолбнячный иммуноглобулин, иммуноглобулин против клещевого энцефалита, против гепатита В, варицелла-зостер, противоаллергический иммуноглобулин и др.
Иммуноглобулины для внутривенного введения представляют собой широкий спектр высокоочищенных антител, преимущественно IgG, от нескольких тысяч доноров. Благодаря этому они обладают нейтрализующей активностью против многих бактерий, вирусов, грибов и простейших. Применяются для лечения тяжелых форм инфекционных заболеваний. В педиатрической практике используют иммуноглобулины как отечественного (имбио), так и зарубежного производства (октагам, интраглобин, пентаглобин и др.). Для достижения этиотропного эффекта назначают высокие дозы - из расчета 400 мг/кг и выше - до 2 г/кг на курс лечения.
Фаготерапия основана на лизисе бактерий. Фаг - это вирус, поражающий бактерии. Он строго специфичен в отношении определенного вида микроорганизмов. В настоящее время имеется тенденция к более широкому применению фаготерапии. Используют стафилококковый, дизентерийный, сальмонеллезный, колипротейный фаги и др.
Вакцинотерапия в педиатрической практике не нашла широкого применения. Имеется опыт применения вакцины БЦЖ с целью иммунокоррекции при хроническом вирусном гепатите В.
64. Реакция преципитации.
Реакция преципитации (РП) - это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах; избыток одного из них снижает уровень образования иммунного комплекса.
РП ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др. Широкое распространение получили разновидности РП в полужидком геле агара или агарозы: двойная иммунодиффузия по Оухтерлони, радиальная иммунодиффузия, иммуноэлектрофорез и др.
Механизм. Проводится с прозрачными коллоидными растворимыми антигенами, экстрагированными из патологического материала, объектов внешней среды или чистых культур бактерий. В реакции используют прозрачные диагностические преципитирующие сыворотки с высокими титрами антител. За титр преципитирующей сыворотки принимают то наибольшее разведение антигена, которое при взаимодействии с иммунной сывороткой вызывает образование видимого преципитата — помутнение.
Реакция кольцепреципитации ставится в узких пробирках (диаметр 0,5 см), в которые вносят по 0,2—0,3 мл преципитирующей сыворотки. Затем пастеровской пипеткой медленно наслаивают 0,1—0,2 мл раствора антигена. Пробирки осторожно переводят в вертикальное положение. Учет реакции производят через 1—2 мин. В случае положительной реакции на границе между сывороткой и исследуемым антигеном появляется преципитат в виде белого кольца. В контрольных пробирках преципитат не образуется.
Не нашли то, что искали? Воспользуйтесь поиском:
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
| | | 





