Кишечная палочка в генной инженерии
Генетическая рекомбинация заключается в обмене генами между двумя хромосомами. Обмен генами и введение в клетку гена, принадлежащего другому виду, можно осуществить посредством генетической рекомбинации. Этот подход был разработан на бактериях, в частности на кишечной палочке, в клетки которой вводили гены животных, человека и добивались их репликации (размножения). Выделение фрагментов ДНК в хромосомах, несущих гены с необходимыми свойствами, производят с помощью вырабатываемых клетками бактерий ферментов рестрикции (рестриктаз).В клетках кишечной палочки и других бактерий были обнаружены ферменты, разрезающие на куски ДНК вирусов и других фагов (там где расположены специфические последовательности нуклеотидов), и тем самым защищающие клетку от разрушения.
Рестриктазыраспознают в ДНК специфичные для них участки длиной в 4-6 пар нуклеотидов и разрезают обе цепи ДНК посередине этих участков или с некоторым смещением. В первом случае образуются обрывки с ровными (тупыми) концами, во втором - стороны оборванных цепочек ДНК чуть-чуть заходят одна за другую. Такие концы называются липкими, они могут слипаться между собой в силу комплиментарности.
Скрепить липкие концы помогает ДНК-лигаза,сшивающая фосфодиэфирные связи.
Для кодирования среднего белка из 400 аминокислот нужен участок ДНК длиной 1200 пар нуклеотидов. В России и за рубежом из различных бактерий выделено несколько сотен рестриктаз, разрезающих ДНК в строго определенных местах, там, где фермент прикреплялся. При этом было установлено, что концы фрагментов ДНК, полученные с помощью обработки хромосом одной и той же рестриктазой, способны слипаться между собой в силу комплиментарности. Две совершенно не схожие между собой последовательности ДНК (например, слона и лягушки) образуют одинаковые липкие концы, если эти ДНК обработать одной и той же рестриктазой. В настоящее время известно более 500 рестриктаз, способных рубить ДНК в120 различных последовательностях. Это дало возможность получать фрагменты ДНК, содержащие желаемые гены. Участки ДНК, разрезаемые рестриктазами, несложно разделить с помощью электрофореза. ДНК, обработанную рестриктазой, вводят в гель агарозы, помещенной в электрическое поле. Под действием электрического поля фрагменты ДНК начинают перемещаться в пористом геле. Короткие фрагменты движутся быстрее, чем длинные, они отделяются друг от друга, не повреждаются и не утрачивают биологических свойств. Скрепить сцепившиеся липкие концы фрагментов разных ДНК помогает фермент ДНК-лигаза.Она сшивает фрагменты с образованием полной структуры двойной спирали ДНК.
Следующей задачей было создание функционально активных, способных реплицироваться гибридных ДНК. С этой целью интересующий фрагмент ДНК включают в состав вектора, с помощью которого он может быть размножен. Вектор- это молекула ДНК, способная переносить в клетку чужеродную ДНК любого происхождения и обеспечивать там ее размножение. Клетки, в которые вектор переносит вшитый в него ген, получили название реципиентов.
В качестве векторов чаще всего используют плазмиды бактерий. Главное свойствоплазмид состоит в их способности реплицироваться независимо от хромосомы. По размеру ДНК плазмиды в 100 раз меньше ДНК бактериальной хромосомы. В плазмиде таких размеров все же может разместиться до сотни генов.
Плазмиды повышают устойчивость бактерий к внешним факторам, защищают их от неблагоприятных воздействий.
Выяснилось, что многие мелкие плазмиды содержат по одному участку для нескольких рестриктаз. Каждая такая рестриктаза не разорвет плазмиду на несколько мелких кусков, а лишь разрежет кольцо плазмидной ДНК и переведет ее в линейное состояние. Первая такая плазмида была открыта английским ученым Стэнли Коуэном в 1974 г.,которую он назвал своим именем.Она самостоятельно размножается. Концы ее способны слипаться между собой или с любыми фрагментами другой ДНК, получаемыми под действием той же рестриктазы. Несет ген устойчивости к тетрациклину и легко обнаруживается при выращивании на среде с антибиотиком.
Помимо плазмид, в качестве векторов стали использовать и ДНК вирусов, размножающихся в клетках бактерий. Клетка, получившая гибридную ДНК, размножившись, образует клон. Это открыло путь для производства различных белков, лекарственных препаратов, гормонов, путем искусственногосинтеза их генов и вставки их в клетки с помощью плазмид. Важнейший из них -инсулин, получаемый из поджелудочной железы свиней.
Генная инженерия - раздел молекулярной генетики, связанный с конструированием несуществующих в природе сочетаний генов при помощи генетических и биохимических методов.
Метод генетической инженерии относится к числу перспективнейших при получении многих белковых биологических веществ, представляющих ценность для медицины. Этим методом получены: интерфероны, интерлейкины, инсулин, гормон роста, тканевый активатор плазминогена, вакцина против гепатита В, моноклональные антитела для предупреждения отторжения при пересадки почки, диагностические препараты для выявления ВИЧ и другие.
С помощью генной инженерии создаются препараты второго поколения, т.е. аналоги природных веществ, обладающих большей эффективностью действия.
Тема 13.Основы экологической микробиологии.
Микрофлора тела здорового человека.
Содержание:
- Основные понятия по микроэкологии.
- Микрофлора тела здорового человека.
- Значение микрофлоры тела в жизни человека.
- Микрофлора окружающей среды.
- Основы санитарной микробиологии.
ОСНОВНЫЕ ПОНЯТИЯ ПО МИКРОЭКОЛОГИИ
Экология микроорганизмов - наука о взаимоотношениях микробов друг с другом и с окружающей средой. В медицинской микробиологии объектом изучения служит комплекс взаимоотношений микроорганизмов с человеком.
Популяция – совокупность особей одного вида, обитающих в пределах определенного биотопа.
Биотоп – территориально ограниченный участок биосферы с относительно однородными условиями жизни.
Микробиоценоз – сообщество популяций микроорганизмов, обитающих в определенном биотопе.
Типы взаимоотношений микробов в биоценозах
Симбиоз - совместное длительное существование микроорганизмов в долгоживущих сообществах. При этом обе популяции извлекают для себя пользу.
Коменсализм - разновидность симбиоза, при которой выгоду извлекает только один партнер, не принося видимого вреда другому
Паразитизм
Антагонистический симбиоз - симбиотические отношения, наносящие хозяину более или менее выраженный вред; его крайнее проявление паразитизм. Паразитические виды живут за счет живых тканей растений и животных. Проникая в организм хозяина, они могут вызывать у него заболевание, поэтому их обозначают как патогенные микроорганизмы.
Факультативные паразиты в зависимости от внешних условий могут вести себя как паразиты, либо как сапрофиты. К ним относятся большинство условно-патогенных бактерий.
Облигатные паразиты в естественных условия размножаются только в организме хозяина, вне организма они могут сохраняться лишь некоторое время, не размножаясь. В организме они размножаются внеклеточно или внутриклеточно.
Факультативно внутриклеточные паразиты лучше размножаются в цитоплазме или ядре клеток, но могут размножаться и вне клетки (менингококки, гонококки, микобактерии туберкулеза и др.).
Облигатно внутриклеточные паразиты размножаются только в клетках организма-хозяина (риккетсии, хламидии, вирусы).
Антагонизм
При антагонизме (конкуренции) происходит подавление жизнедеятельности одной популяции другой. Формы истребления могут быть вариабельными - от банального поглощения более мелких видов до выделения высокоспецифичных продуктов, токсичных для конкурента (бактериоцины, антибиотики, фитонциды, интерферон, органические и жирные кислоты и др.)
МИКРОФЛОРА ТЕЛА ЗДОРОВОГО ЧЕЛОВЕКА
Основные микробные биотопы
Кожа
На кожных покровах микроорганизмы подвержены действию бактерицидных факторов сального секрета, повышающих кислотность. В подобных условиях живут преимущественно Staphylococcus epidermidis, микрококки, сарцины, аэробные и анаэробные дифтероиды. Соблюдение элементарных правил гигиены может уменьшить число бактерий на 90%.
Дыхательная система
В верхние дыхательные пути попадают пылевые частицы, нагруженные микроорганизмами, большая часть которых задерживается в носо- и ротоглотке. Здесь растут бактероиды, коринеморфные бактерии, гемофильные палочки, пептококки, лактобактерии, стафилококки, стрептококки, непатогенные нейссерии и др. Трахеи и бронхи обычно стерильны.
Мочеполовая система
Микробный биоценоз органов мочеполовой системы более скудны. Верхние отделы мочевыводящих путей обычно стерильны; в нижних отделах доминируютStaphylococcus epidermidis, негемолитические стрептококки, дифтероиды; часто выделяют грибы родов Candida. В наружных отделах доминируют Mycobacterium smegmatis. В микробиоценоз влагалища включены молочнокислые бактерии, энтерококки, стрептококки, стафилококки, коринебактерии, палочки Додерлайна.
Рис. 2. Нормофлора влагалища.
Полость рта
Ротовая полость является удобным местом для развития микроорганизмов. Влажность, обилие питательных веществ, оптимальная температура, слабо щелочная реакция среды являются благоприятными факторами для развития микроорганизмов. Поэтому микрофлора полости рта чрезвычайно обильна и разнообразна.
Среди бактерий доминируют стрептококки, составляющие 30-60% всей микрофлоры ротоглотки. Менее аэрируемые участки колонизируют анаэробы - актиномицеты, бактероиды, фузобактерии и вейлонеллы. В полости рта также обитают спирохеты,микоплазмы, грибы рода Candida и разнообразные простейшие.
Нормальная микрофлора ротовой полости может быть причиной воспалительных процессов и кариеса зубов, однако, при огромном количестве микробов в полости рта воспалительные процессы возникают сравнительно редко. Защитное значение имеют барьерная функция слизистой оболочки и эмали зубов, фагоцитоз.
Рис. 3. Трехдневный зубной налет (электронная фотография).
Рис. 4. Хеликобактер (электронная фотография).
Верхние отделы тонкой кишки также относительно свободны от бактерий, что связано с неблагоприятным действием щелочного рН и пищеварительных ферментов. Тем не менее в этих отделах можно обнаружить кандиды, стрептококки и лактобациллы.
Нижние отделы тонкой и, особенно, толстая кишка - огромный резервуар бактерий; их содержание может достигать 1012 в 1 г фекалий (30% сухой массы кала).
Микрофлора кишечника представлена тремя основными группами.
К 1-й группе относятся грамположительные бесспоровые анаэробы - бифидобактерии и грамотрицательные бактероиды, составляющие 95% микробиоценоза.
Рис. 5. Бифидобактерии (слева) и бактероиды (справа) кишечника (световая микроскопия).
2-я группа(сопутствующая микрофлора) представлена в основном аэробами (лактобактерии, кокковая флора, Еscherichia coli) удельный вес ее невелик и не превышает 5%. Лактобактерии и нормальная E. coli являются синергистами бифидобактерий.
Рис. 6. Лактобактерии (слева), кокковая флора (в центре), кишечная палочка (справа) (световая микроскопия).
В 3-ю группу включают редко встречающуюся микрофлору условно-патогенную или факультативную). Ее удельный вес не превышает 0,01-0,001% от общего количества микробов. Представителями факультативной микрофлоры являются протей, синегнойная палочка, стафилококк, кандида, серрацина, цитро-, энтеро- и кампилобактерии.
Представители 2-й и 3-й групп в физиологических условиях являются симбионтами 1-й группы, прекрасно с ней сосуществуют, не нанося вреда, проявляя агрессивные свойства лишь при определенных условиях.
Не нашли то, что искали? Воспользуйтесь поиском:
03 февраля 2020
- 849
- 0,0
- 0
- 2
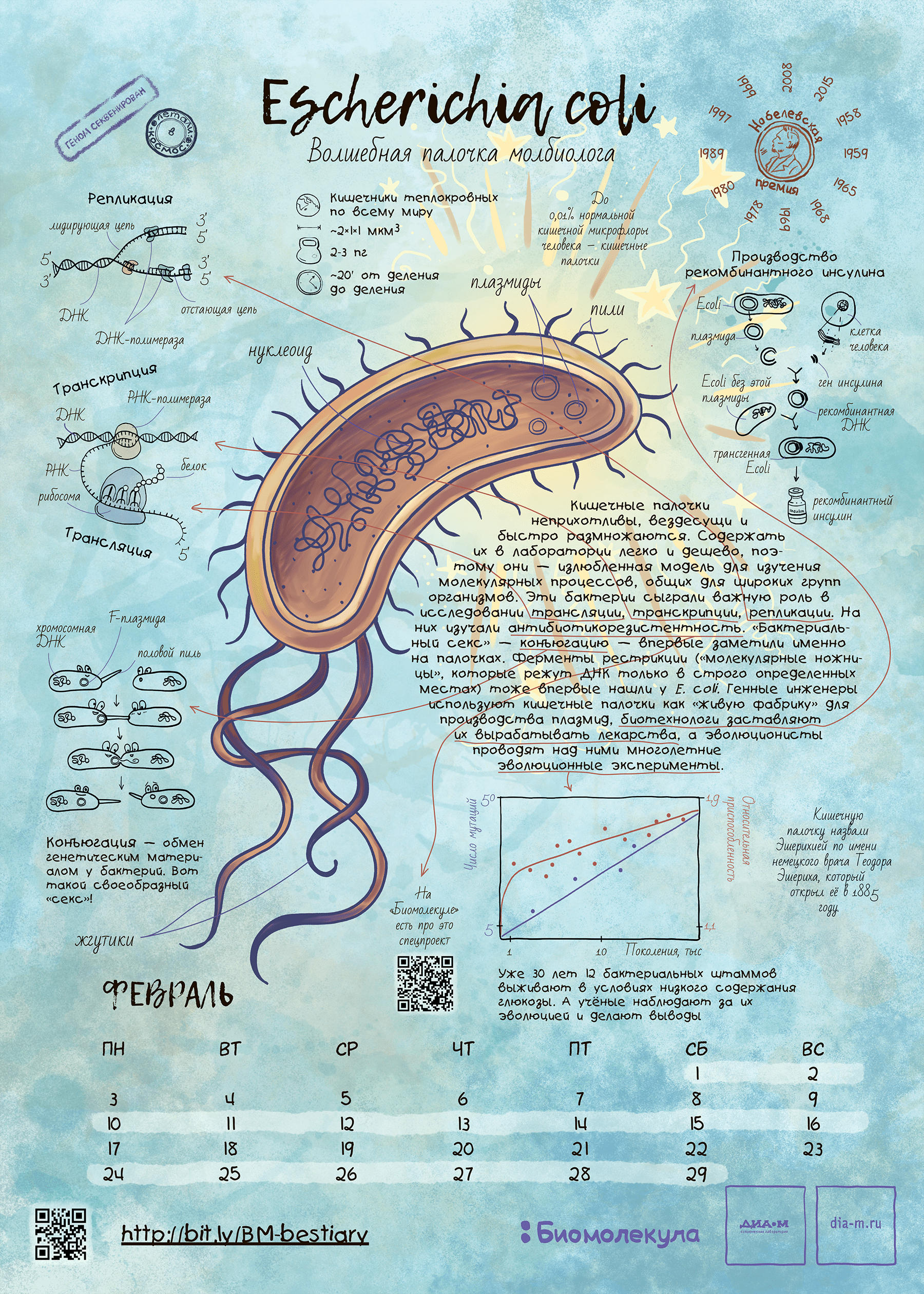
Герой февраля: кишечная палочка Escherichia coli
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
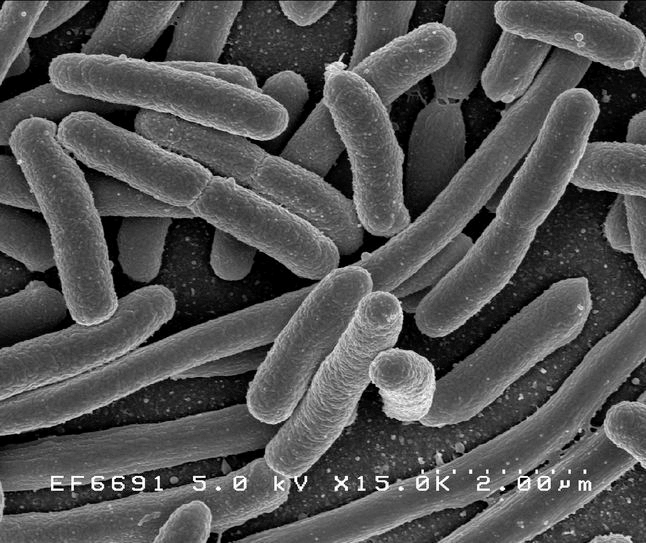
Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Клетки с относительно тонкой клеточной стенкой, не окрашивающиеся красителем генцианом фиолетовым (окраской бактерий по методу датского микробиолога Кристиана Грама).
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
Кстати, Джошуа Ледерберг был некоторое время мужем Эстер Ледерберг, первооткрывательницы бактериофага лямбда [3].
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
Благодарность
Кишечная палочка (лат. Escherichia coli, E. coli, по имени Теодора Эшериха) - грамотрицательная палочковидная бактерия, широко встречается в нижней части кишечника теплокровных организмов.E. coli - грамотрицательная бактерия, факультативный анаэроб, не образует эндоспор. Клетки палочковидные, со слегка закруглёнными концами, размером 0,4-0,8 х 1-3 мкм, объём клетки составляет около 0,6-0,7 мmі. Штаммы, имеющие жгутики, способны передвигаться. Жгутики расположены перитрихально. Протопласт E. coli одет в муреиновый мешок, прилегающий к внешней мембране. E. coli относится к микроорганизмам, не обладающим физиологической компетентностью к поглощению экзогенной ДНК.

Кишечная палочка может жить на разных субстратах. В анаэробных условиях E. coli образует в качестве продукта жизнедеятельности лактат, сукцинат, этанол, ацетат и углекислый газ. Часто при этом образуется молекулярный водород, который мешает образованию указанных выше метаболитов, поэтому E. coli часто сосуществует с микроорганизмами, потребляющими водород - например, с метаногенами или бактериями, восстанавливающими сульфат.

Оптимальный рост достигается культурами E. coli при температуре 37 °C, некоторые штаммы могут делиться при температурах до 49 °C. Рост может стимулироваться аэробным или анаэробным дыханием, различными парами окислителей и восстановителей, в том числе, окислением пирувата, формиата, водорода, аминокислот, а также восстановлением кислорода, нитрата, диметилсульфоксида и триметиламин N-оксида.
E. coli играет важную роль в современной промышленной микробиологии и биологической инженерии. Работа Стенли Нормана Коэна и Герберта Бойера на E. coli, с использованием плазмид и эндонуклеаз рестрикции для создания рекомбинантной ДНК, находится у истоков современной биотехнологии. Усовершенствование методов получения сферопластов E. coli и их трансфекции позволили достичь достаточно высокой эффективности трансформации молекулами ДНК различных фагов.
Кишечную палочку считают универсальным организмом для синтеза чужеродных белков. В E. coli исследователи вводят гены при помощи плазмид, что позволяет осуществлять биосинтез белков для промышленной ферментации. Также разработаны системы для синтеза в E. coli рекомбинантных белков. Одним из первых примеров использования технологии рекомбинантных ДНК является синтез аналога инсулина человека. Модифицированные E. coli используют при разработке вакцин, синтеза иммобилизованных ферментов и решения других задач. Однако, в организмеE. coli невозможно получать некоторые крупные белковые комплексы, содержащие дисульфидные связи, в частности, белки, для проявления биологической активности которых требуется посттрансляционная модификация.
Чужеродные гены клонируют в так называемых челночных векторах. Эти вектора с одинаковым успехом реплицируются в клетках нескольких хозяев, в данном случае, в клетках E. coli. Векторы были получены комбинацией in vitro фрагментов этих плазмид.
Для конструирования рекомбинантной ДНК, содержащей в своем составе ген, который должен экспрессироваться, придерживаются следующей стратегии. Синтезируют к ДНК или из клонотеки выделяют клетки, несущие фрагмент генома с нужным геном, и клонируют их в соответствующем векторе. Фрагменты геномной ДНК подвергают модификации - удаляют из них некодирующие области и участки соседних генов. Часто для проведения этой операции необходимо секвенирование данного фрагмента ДНК. Затем конструируются промежуточные рекомбинантные ДНК, в которых ген помещается под контроль бактериальных регуляторных элементов (промотор, оператор, точка связывания с рибосомами). Эти регуляторные элементы выделяют из гибридных плазмид, сконструированных специально как источники регуляторных элементов. Полученная конструкция встраивается в подходящий вектор, например, pBR 322, и ген экспрессируется в бактериальной клетке.
Однако удобнее встраивать ген в специальный вектор для экспрессии, который уже содержит регуляторные элементы, обеспечивающие активную экспрессию после введения рекомбинантной плазмиды в бактериальную клетку. К таким эффективным регуляторным участкам относится, например, сильный промотор гена бэта-лактамазы (ген устойчивости к пенициллину, входящий в состав плазмиды pBR 322). Ряд генов, в том числе и ген инсулина, встраивали в сайт рестрикции Pst I, который расположен в структурной части гена. Промотор этого гена обеспечивает эффективную транскрипцию, которая продолжается до тех пор, пока РНК-полимераза не дойдет до сигнала терминации встроенного гена.
В качестве примера маркирования вектора могут служит первые эксперименты с E. coli, а точнее с одной из ее плазмид рBR322, проведенные Гилбертом для получения инсулина. Плазмида pBR322 содержит 2 гена, которые определяют устойчивость к ампициллину и тетрациклину. Рестриктаза PstI расщепляет плазмиду в средней части гена, кодирующего фермент устойчивости к ампициллину. После расщепления плазмиды на ее концы с помощью концевой трансферазы надстраивали последовательность из четырех нуклеотидов с остатками гуанина. Затем, как обычно, с помощью лигаз "вшивали" ген проинсулина, получая рекомбинантную ДНК. Встроенный в плазмиду фрагмент ДНК нарушал синтез фермента, разрушающего ампициллин, но ген, обеспечивающий устойчивость к тетрациклину, оставался активным. Трансформированные таким образом клетки E. coli синтезировали гибридный белок, содержащий последовательности пенициллазы и проинсулина, поэтому биологически активный инсулин получали путем отщепления пенициллазы и среднего сегмента проинсулина.
С другой стороны, если фрагмент чужеродной ДНК встраивается в один из генов устойчивости, то последний инактивируется. Следовательно, успешное встраивание фрагмента чужеродной ДНК в один из этих генов легко детектировать по исчезновению у бактерий устойчивости к данному антибиотику.

Несмотря на существование очевидных преград и трудностей, которые подчас встают на пути развития и внедрения продуктов генной инженерии (ГИ), XXI век уже невозможно представить без плодов этой важной и многообразной технологии в арсенале современного биолога. Наиболее часто используемым организмом в ГИ являются бактерии.
Что такое ГИ и зачем она нам нужна? Почему бактерии так популярны у генных инженеров? В каком виде проще всего внести нужный ген в бактерию? С какими трудностями можно столкнуться, работая с этими организмами? Что произошло раньше: создание первой генноинженерной бактерии или открытие структуры ДНК и генома? Об этом и многом другом читайте под катом.
В данном пункте приведено краткое описание так называемой Центральной догмы молекулярной биологии. Если вы обладаете базовыми знаниями в молекулярной биологии, то смело переходите к пункту 1.

Центральная догма молекулярной биологии в одной картинке
Итак, начнём. Вся информация о всех стадиях развития и свойствах любого организма, будь то прокариоты (бактерии), археи или эукариоты (все остальные одно- и многоклеточные), закодирована в геномной ДНК, которая представляет собой комплекс двух комплементарных друг другу полинуклиотидных цепей, образующих двойную спираль (комплементарные нуклеотиды ДНК: A-T и G-C). Хромосомы эукариот представляют собой линейные двухцепочечные молекулы ДНК, а хромосомы прокариот закольцованы. Зачастую гены составляют лишь небольшую часть всего генома (у человека — около 1,5%).
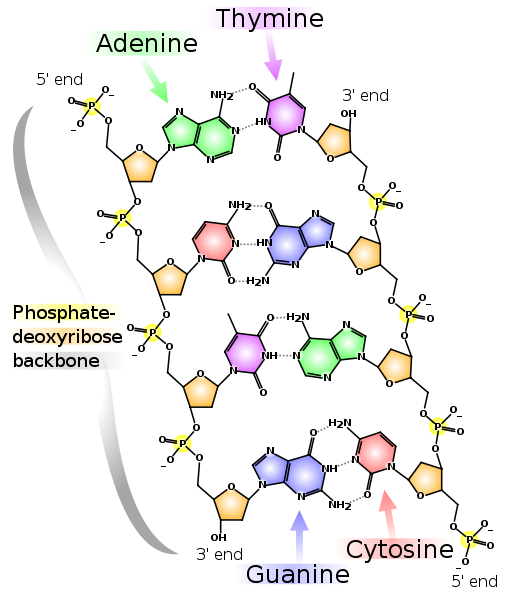
Две комплементарные друг другу цепи ДНК. Пунктирными линиями показаны водородные связи между основаниями. Как видно, аденин и тимин образуют между собой две водородные связи, а гуанин и цитозин — три. Поэтому связь G-C прочнее и GC-богатые участки двухцепочечной ДНК сложнее разделить на две цепочки.
Цепочки ДНК и РНК.
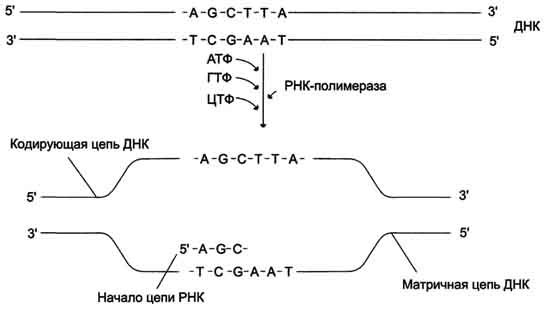
Последовательности ДНК и РНК всегда записывают от 5'-конца к 3'-концу. На то есть ряд причин:
- Синтез новых цепочек ДНК и РНК начинается с 5'-конца (ДНК-полимеразы (ферменты, синтезирующие комплементарную цепь ДНК на матрице ДНК или РНК) и РНК-полимеразы (ферменты, синтезирующие комплементарную цепь РНК на матрице ДНК или РНК) идут по матрице в направлении 3' -> 5', стало быть новая цепь синтезируется в направлении 5' -> 3');
- Рибосома читает кодоны, передвигаясь по мРНК в направлении 5' -> 3';
- Последовательность аминокислот записана в кодирующей цепи ДНК в направлении 5' -> 3' (значащая часть мРНК представляет собой точную копию участка кодирующей цепи ДНК с заменой тимина на урацил и с гидроксильной группой (-OH) вместо водорода в положении 2', разумеется);
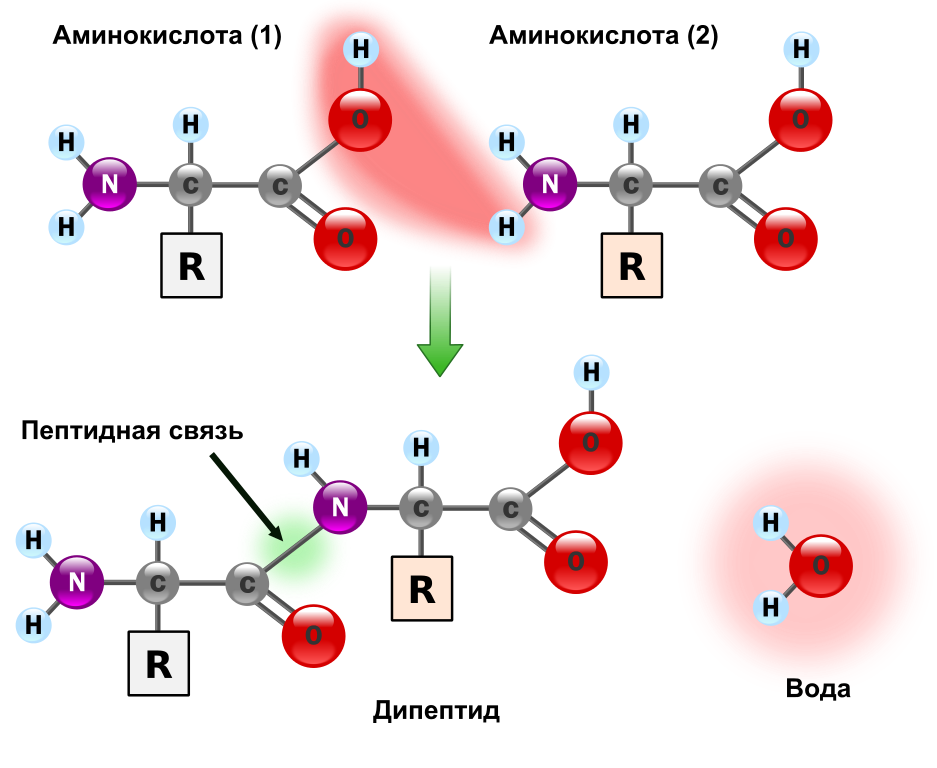
Ген — это участок геномной ДНК, задающий последовательность нуклеотидов молекулы РНК:
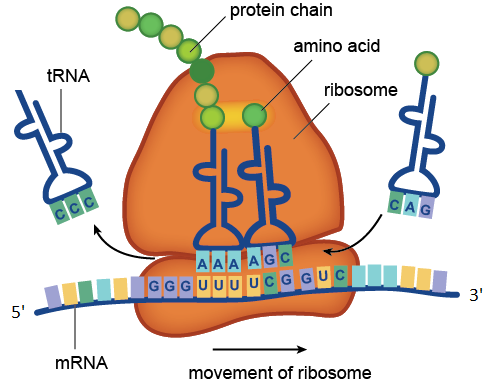
Процесс трансляции, катализируемый рибосомой. На рисунке находящиеся в составе мРНК кодоны UUU и UCG распознаются находящимися в составе молекул тРНК антикодонами AAA и AGC. Транспортная РНК с антикодоном CCC уже отдала свою аминокислоту растущей белковой цепочке, а тРНК с антикодоном CAG ждёт своей очереди. Показанный на рисунке участок молекулы мРНК состоит из четырёх кодонов: GGGUUUUCGGUC. Кодон GGG соответствует аминокислоте глицину, UUU — фенилаланину, UCG — серину, GUC — валину. Значит данный участок мРНК кодирует фрагмент белка с аминокислотной последовательностью глицин-фенилаланин-серин-валин.
Рибосомные РНК — незаменимые компоненты рибосомы. Основной функцией рРНК является обеспечение процесса трансляции: она участвует в считывании информации с мРНК при помощи адапторных молекул тРНК и катализе образования пептидных связей между присоединёнными к тРНК аминокислотами и растущей цепью белка.
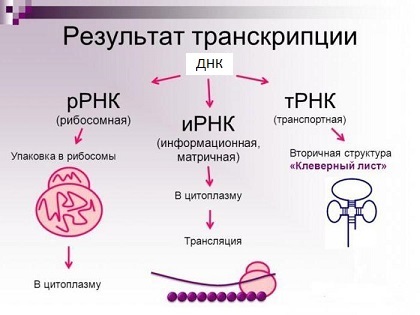
Основные типы молекул РНК (на самом деле их куда больше).
В случае с генами, кодирующими белок процесс расшифровки генетической информации выглядит так:

Прокариотический транскприпционный комплекс. Указанные на рисунке буквы являются общепринятыми обозначениями соответствующих субъединиц. σ70 — сигма фактор генов домашнего хозяйства E. coli

Кодоны в стандартном генетическом коде. Спасибо википедии за картинку.
Бактерия в генной инженерии — это потенциальный исходный материал для создания:
Интересным является тот факт, что первые успешные опыты в области генной инженерии бактерий произошли задолго до эпохальной работы Уотсона и Крика. Более того, на основании этих опытов был доказан сам факт того, что информация содержится именно в ДНК, после чего учёные могли не тратить своё время на гипотезы об РНК и белке.
Таким образом, было доказано, что носителем информации о признаках является именно ДНК. Кроме того, было наглядно показано, что возможно самопроизвольное проникновение инородной молекулы ДНК в бактериальную клетку.
Почему бактерии так популярны при очевидных недостатках (например, отсутствие эукариотических посттрансляционных модификаций)? Всё просто. Они неприхотливы в работе, просты в использовании и не требуют дорогих питательных сред.
Современная генная инженерия бактерий в основном представляет собой внедрение плазмидного вектора (модифицированной бактериальной плазмиды, содержащей целевой ген и набор других необходимых элементов, о которых речь пойдёт ниже). Изменение хромосомы бактерии менее типично, но эта процедура также не является чем-то диковинным: например, ген РНК-полимеразы бактериофага Т7 был введёт в хромосому кишечной палочки с помощью вектора на основе профага λ в процессе создания одного из популярных в лабораторной плактике штаммов. Причин, по которым зачастую исследователь выберет внедрение гена в составе плазмидного вектора три:
Кроме гена и промотора основными элементами плазмидного вектора являются:
-
ori — область начала репликации плазмиды. Нужна для поддержания постоянного количества плазмиды и её наследования дочерними клетками;
Другим примером может служить, использование гена β-глюкуронидазы (GUS). Данный фермент превращает определённые соединения в окрашенные или флуоресцирующие, что может быть обнаружено визуально по окрашенности колонии. Естественно, данные соединения нужно добавлять в питательную селективную среду. Ещё один пример — использование гена зелёного флуоресцентного белка (GFP) (хотя использование GUS и GFP более типично для работ с клетками растений и животных);
участок, отвечающий за контроль копийности (мало плазмид в клетке — плохо, много — тоже плохо);
Что ж, вектор у нас на руках. Как в него встроить ген? И вообще, где этот ген взять?
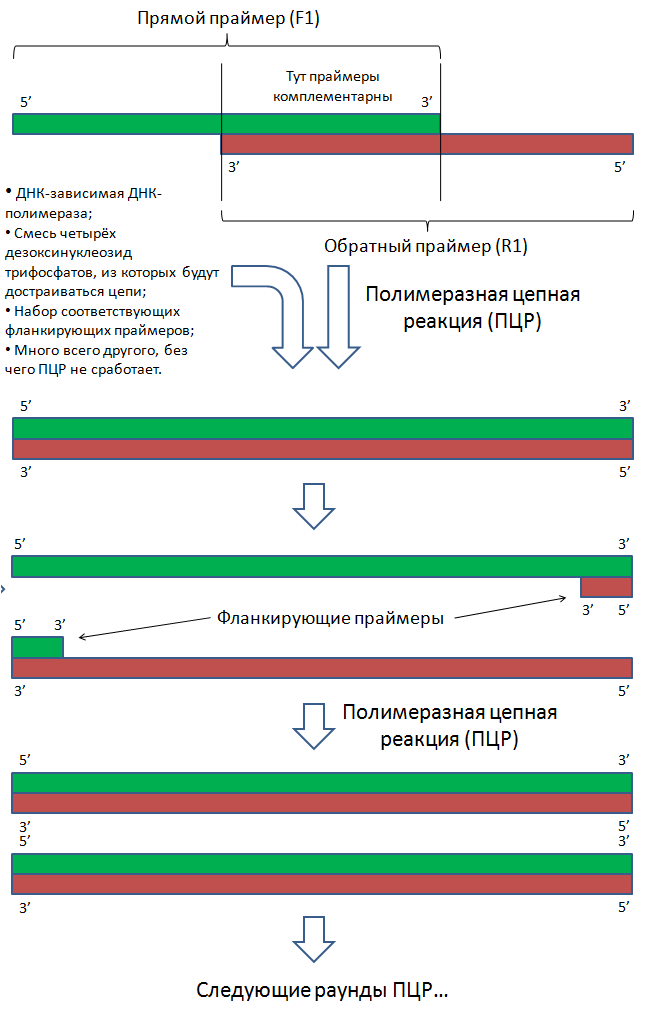
Допустим, что мы знаем последовательность нуклеотидов нужного нам гена. Тогда поступают следующим образом:
- Химически синтезировать короткие одноцепочечные полинуклеотиды таким образом, чтобы они частично перекрывались;
- Объединить эти фрагменты с помощью ПЦР.
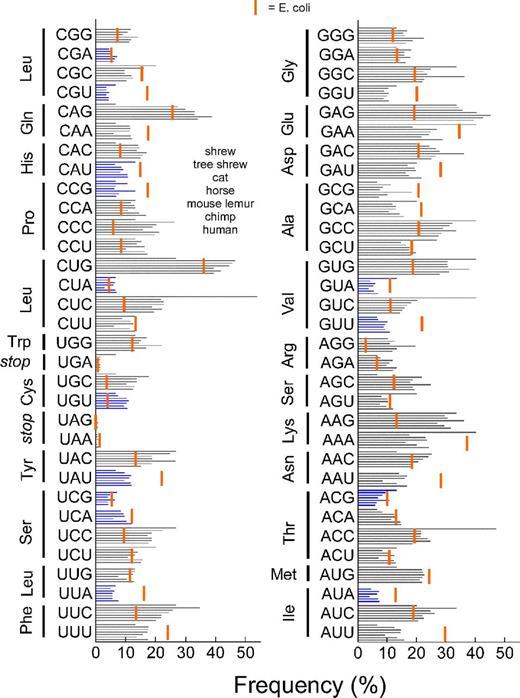
На рисунке синими полосками показаны частоты кодонов у землеройки, тупайи, домашней кошки, лошади, мышиного лемура, шимпанзе и человека. Красной полосой отмечена частота кодонов у кишечной палочки E. coli.
-
Система на основе регуляторных элементов лактозного оперона E. coli (lac-оперона) и сильного промотора.
Дело в том, что у кишечной палочки есть свои правила питания. Во-первых, существует механизм подавления активности lac-оперона, который включён только тогда, когда в клетку не поступает лактоза. Это логично: зачем тратить силы на синтез того, что не пригодится? Но как только лактоза начинает поступать в клетку в достаточном количестве этот механизм выключается.
Однако, есть второй механизм подавления активности lac-оперона. Если в среде есть глюкоза, то клетка питается исключительно глюкозой, так как она активирует второй механизм ингибирования транскрипции lac-оперона. Таким образом, lac-оперон активен только тогда, когда в окружающем клетку пространстве есть только лактоза. Минусом лактозного оперона является крайне слабый промотор, поэтому в штаммах продуцентах он заменён на сильный. Сильные промоторы часто получают из патогенов. Наиболее широко используемые в генной инженерии прокариот сильные промоторы выделены из бактериальных вирусов — бактериофагов. Например, широко используется промотор фага Т7.
К слову, некоторые сильные промоторы для генной инженерии растений также выделены из вирусов, например, это промотор вируса мозаики цветной капусты.

Как было указано выше, у E. coli нет РНК-полимеразы, которая бы узнавала промоторы бактериофагов, поэтому предварительно в продуцент встраивают ген РНК-полимеразы соответствующего бактериофага.
Можно поступить и по-другому: вообще не добавлять в питательную среду глюкозу и лактозу, а потом, когда культура дорастёт до нужной плотности, добавить то, что клетка примет за лактозу, но не сможет метаболизировать или разрушить. Сейчас в качестве такого индуктора используют ИПТГ.
Система на основе регуляторного механизма промотора pL бактериофага λ.
Данный промотор инактивируется белком-репрессором cI. При этом была обнаружена термочувствительная форма этого белка, названная cI857: данный фактор транскрипции сохраняет функциональность при температуре около 30⁰С и теряет её при 42⁰С. Поэтому при использовании такой системы сначала бактериальную культуру растят до нужной плотности при 30⁰С, а затем поднимают температуру до 42⁰С, тем самым запуская синтез целевого белка.
Ну что же, вектор разработан. Дальше дело за малым — найти подходящий метод для его внесения в бактериальную клетку. Но это уже совсем другая история.
Читайте также:


