Кандидоз желчного пузыря лечение
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже известные варианты болезни и описываются редкие и новые нозологические формы.
Грибы, являясь нормальными комменсалами желудочно-кишечного тракта (ЖКТ), становятся патогенными при определенных условиях. Это касается в основном дрожжеподобных грибов Candida spp., виды и даже штаммы которых различаются по факторам агрессии, способности к адгезии и инвазии [15].
Грибы Candida (условно-патогенные микроорганизмы) заселяют ЖКТ — этот феномен называется колонизацией, — процесс протекает бессимптомно. Исследование взрослых здоровых добровольцев показало, что Candida albicans присутствует в орофарингеальной зоне у 20–30% из них, в тонком кишечнике — у 50–54%, в толстом кишечнике — у 55–70% и в фекалиях — у 65–70% [9, 13]. При исследовании состава микрофлоры полости рта у населения нескольких стран Европы обнаружено присутствие грибов у 10–25% людей, в кале — у 65–80% [11, 17]. Детально изучена колонизация зева грибами Candida у больных гемобластозами: она составила 33% [8]. В биоптатах гастродуоденальных язв в 17–30% случаев находят дрожжеподобные грибы [12]. У 50% жителей Германии в микробиоте кишечника присутствуют грибы, а у онкогематологических больных колонизация кишечника составляет 63–65% [10, 11]. Нельзя забывать, что у 0,8–4% пациентов грибы случайно обнаруживаются в пузырной и протоковой желчи, а при желчнокаменной болезни — у 15–20%.
Бессимптомное пребывание грибов в ЖКТ может прекратиться, когда они приобретают патогенные свойства. Так, у больных с нейтропенией грибы из кишечника могут диссеминировать в печень, селезенку и легкие, а в катетер-ассоциированной ситуации грибы попадают непосредственно в ток крови, достигают сердца и почек.
Дрожжеподобный гриб Cryptococcus neoformans в патологии ЖКТ как этиологический фактор играет незначительную роль. Он чаще поражает нервную систему и, диссеминируя из первичного очага, вовлекает гастроинтестинальный тракт. Описаны единичные случаи (чаще посмертно) криптококкового эзофагита, стоматита, терминального илеита, колита, холецистита, панкреатита. Как правило, они относились к ВИЧ-серопозитивным больным, а также к пациентам, страдающим гипергаммаглобулинемией Е с рецидивирующими абсцессами печени и перианальной зоны.
Болезни ЖКТ, вызванные диморфными патогенными грибами (II группы патогенности), зарегистрированы в Южной Америке, но время от времени встречаются как спорадические случаи по всему миру. Большинство диморфных грибов в природе существуют в мицелиальной форме, попав в организм они трансформируются в дрожжеподобные и приобретают патогенные свойства. Пероральный путь проникновения не характерен, в ЖКТ эти грибы попадают при диссеминации из других органов. Blastomyces dermatitidis продуцирует гранулематозное повреждение в желудке и тонком кишечнике. Coccidioides immitis, Histoplasma capsulatum, Paracoccidioides brasiliensis и Sporothrix schenckii поражают кишечник только при диссеминации из кожных очагов и респираторного тракта [6, 15].
Грибы Aspergillus spp. редко вызывают болезнь ЖКТ, только в случаях стойкой нейтропении, кахексии и при других отягощающих состояниях.
Грибы класса Zygomycetes могут привести к развитию интестинального зигомикоза, который, как правило, ассоциирован с амебиазом, голоданием, диабетическим кетоацидозом, почечным гемодиализом. Penicillium spp. и Geotrichum поражают ЖКТ также редко.
Дрожжеподобные, плесневые и некоторые диморфные грибы — это условно-патогенные, оппортунистические микроорганизмы, которые широко распространены в окружающей среде и легко могут попадать на кожу, слизистые оболочки полости рта, гениталий и в дыхательные пути. Кроме того, для грибов характерен эндогенный способ существования (миконосительство).
При физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, а с другой — факторы патогенности грибов.
Устойчивость организма зависит от принадлежности к группам риска и состояния иммунной системы.
Перечислим факторы риска развития грибковых инфекций ЖКТ.
- Поражение слизистых оболочек полости рта (красный плоский лишай, зубные протезы, травмы, ксеростомия, использование гормональных ингаляторов).
- Хронические заболевания ЖКТ (атрофический гастрит, гипоацидность желудка, ахалазия, бульбит, эрозивно-язвенные заболевания пищевода и кишечника, дивертикулез, полипоз, гастроэзофагальная рефлюксная болезнь, энтероколит, болезнь Крона, синдром раздраженной кишки, обсемененность желудка Helicobacter pylori, дисбиоз, микст-инфекция кишки).
- Травмирование слизистой оболочки (ожоги, пищеводно-желудочный зонд, эндотрахеальная интубация).
- Беременность.
- Период новорожденности (недоношенность, массивность инфекции при прохождении через родовые пути, естественное несовершенство иммунной системы).
- Пожилой возраст (старение иммунной системы, сопутствующие заболевания, уменьшение амплитуды продольных сокращений пищевода, силы сокращений сфинктеров, нарушение процессов всасывания и т. д.).
- Онкологические и гематологические заболевания (нейтропения).
- Эндокринопатии (особенно сахарный диабет).
- СПИД, ВИЧ-инфицированность.
- Трансплантационные операции.
- Состояния, требующие пребывания в отделениях интенсивной терапии.
- Тяжелые аллергические заболевания.
- Прием антибиотиков, цитостатиков, гормонов и других химиопрепаратов в неадекватных дозах.
- Нарушения питания, в том числе голодание с целью снижения веса.
- Алкоголизм, курение, наркомания.
Важным компонентом защиты от инвазии ЖКТ является иммунная система, ассоциированная с кишечником. Клеточная часть этой системы включает в себя интраэпителиальные лимфоциты, которые препятствуют дисперсии возбудителя через lamina propria и агрегации в пейеровых бляшках. В-лимфоциты кишечника участвуют в продукции секреторных IgA и IgM, которые уменьшают способность грибов к адгезии.
Т-клетки здорового организма продуцируют защитный интерферон, усиливают фагоцитоз, активируют Т-цитотоксические лимфоциты. СД4 и СД8 укрепляют местный иммунитет в ЖКТ. Причем оказалось, что цитотоксичность СД8 играет более существенную роль в предотвращении заболевания, чем предполагали раньше.
В защите важны также макрофагальный и нейтрофильный фагоцитоз, препятствующие диссеминации грибковой, особенно кандидозной инфекции.
Нормальные биохимические, гистохимические и физиологические процессы в ЖКТ, своевременная регенерация эпителиоцитов, кислотно-ферментативный барьер, полноценная перистальтическая активность также являются защитными факторами, которые препятствуют проникновению грибковой и бактериальной флоры [4]. Роль желудочной кислоты в предотвращении внедрения грибов в слизистую неоспорима. В среде с пониженной кислотностью грибы Candida приобретают патогенные свойства, появляются вегетирующие формы, образуется псевдомицелий или мицелий, повреждающий слизистую оболочку. У ВИЧ-инфицированных лиц, для которых характерна ахлоргидрия, попадающие с пищей грибы Candida могут вызывать кандидоз желудка, в то время как у людей с нормальным иммунитетом эта локализация встречается редко. Роль кислотности желудочного сока в развитии бактериальной и грибковой инфекции кишечника не подтверждена.
Нельзя не упомянуть также о Helicobacter pylori, который довольно часто обитает в желудке, вызывает гастрит, язвенную болезнь, а иногда оказывает канцерогенное воздействие. В свою очередь, лечение хеликобактериоза антибиотиками приводит к активации грибов Candida и кандидозу желудка [1]. Ассоциации грибов с Helicobacter pylori и другими бактериями в ЖКТ встречаются нередко, что требует продуманного адекватного подхода к тактике лечения.
Вирулентность грибов, патогенные факторы, как и полисахариды (маннаны), плазмокоагулаза, эндотоксины, липиды, глюкоконъюгаты, влияют на развитие заболевания. Даже от внутривидовых способностей грибов зависит, разовьются ли в каждом конкретном случае кандиданосительство или болезнь [13]. Например, серотип В Candida albicans считается более вирулентным и наиболее распространенным возбудителем орофарингеального кандидоза у ВИЧ-инфицированных больных, также он поражает генитоуринарную систему и нередко выделяется из зева у гомосексуалистов.
Микроскопически факторы агрессии грибов Candida проявляются формированием ростковых трубок, псевдогифов и истинного мицелия — за счет них грибы могут врастать в стенку фагоцитов. Однако дрожжи, которые не способны продуцировать мицелий, такие, как Candida glabrata, Cryptococcus neoformans, также могут вызывать заболевания ЖКТ.
Тщательное изучение анамнеза, выявление факторов риска, хронических заболеваний ЖКТ, патогномоничных клинических симптомов играют большую роль в своевременности установления диагноза.
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить трехмерное изображение, магнитно-резонансное исследование — имеют большое будущее [3].
Еще одним достаточно информативным методом в гастроэнтерологии является рентгенография пищевода, желудка и кишечника. Она дает возможность выявить дефекты наполнения (депо бария), изъязвления, деформацию, конвергенцию складок, изменения контуров и глубины перистальтики, сужение или расширение пищеводной трубки. С помощью рентгенографии желудка можно оценить его моторику, своевременность эвакуации пищевого комка, что важно для понимания патогенеза заболевания.
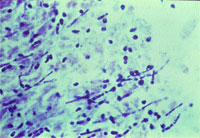 |
| Рисунок 1. Кандидозный эзофагит. Почкующиеся клетки и псевдогифы грибов Candida albicans на эзофагеальной язве |
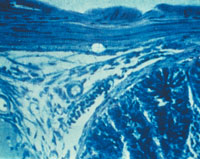 |
| Рисунок 2. Кандидозный энтерит. Утолщенные ворсинки и дефект слизистой тонкой кишки; псевдогифы грибов Candida |
В кале диагностическую значимость приобретает количество колоний (более 10 5 –10 6 ). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, так как это является одним из лабораторных признаков, подтверждающих диагноз кандидоза.
Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому–Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ (рис. 1, 2).
Язвенные дефекты пищевода, желудка и кишечника поддерживают грибковую колонизацию вплоть до инвазии. Желудочно-кишечный кандидоз нередко приводит к кандидемии.
I. Орофарингеальный кандидоз.
- Кандидоз полости рта у новорожденных.
- Псевдомембранозный кандидоз.
- Атрофический кандидоз полости рта (чаще у пожилых).
- Эритематозный кандидоз (новая форма).
- Срединный ромбовидный глоссит.
- Лейкоплакия, ассоциированная с кандидозом.
- Ангулярный кандидозный хейлит.
- Кандидозный гингивит (изолированно встречается редко).
II. Кандидозный эзофагит.
III. Кандидоз желудка.
- Эрозивно-фибринозный гастрит (диффузный).
- Вторичный кандидоз на фоне язвенной болезни.
- IV. Кандидоз кишечника.
- Псевдомембранозный.
- Коллагеновый.
- Лимфоцитарный.
V. Кандидозный проктосигмоидит.
VI. Перианальный кандидоз.
VII. Секреторная диарея, ассоциированная с кандидозом.
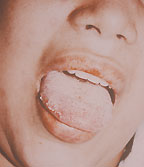 |
| Рисунок 3. Кандидозный глоссит. Типичные белые налеты и эрозии на воспаленной инфильтрированной слизистой |
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная занимает 1-е место (рис. 3).
О кандидозе полости рта упоминал еще Гиппократ, а впервые описал его хирург Лангенберк в 1839 г.
Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам.
Кандидоз ассоциирован также с ношением протезов. При этом развивается атрофический кандидоз, огромное количество грибов скапливается в щечных складках на фоне красного точечного воспаления слизистой; инвазия, как правило, отсутствует.
С. А. Бурова, доктор медицинских наук, профессор
Национальная академия микологии, ГКБ № 81, Москва
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
По данным ВОЗ, в последнее десятилетие человечество переживает эпидемию оппортунистических инфекций, среди которых микозам принадлежит одно из ведущих мест: около 20% населения мира страдает грибковыми заболеваниями. Грибковые поражения возникают в результате дисфункций иммунной системы и дисметаболических расстройств в организме, которые имеют различную этиологию. Неблагоприятная экологическая обстановка, оказывающая отрицательное воздействие на иммунную систему организма человека, также имеет значение в развитии микозов.
Наиболее распространенными возбудителями оппортунистических микозов являются кандиды. Заболеваемость кандидозами значительно возросла с началом эры применения антибиотиков и продолжает расти. Кандидоз может носить системный характер (массивный рост возбудителя в организме) и иметь картину грибкового сепсиса с поражением почек, сердца, селезенки, мозга, а иногда с развитием септического шока.
В статье рассмотрены патогенез грибковых заболеваний человека, резистентность и иммунный ответ организма, уделено внимание микст-инфекции и дисбиозу. Подробно разобраны эпидемиология, клинические проявления и диагностика микозов желудочно-кишечного тракта (ЖКТ) различной локализации: оральный (орофарингеальный) кандидоз, микозы желудка, кандидоз кишечника.
Ключевые слова: микоз, кандидоз, микст-инфекция, дисбиоз, иммунодефицит, СПИД.
Для цитирования: Омаров Т.Р., Омарова Л.А. Грибковые поражения желудочно-кишечного тракта // РМЖ. Гастроэнтерология. 2016. № 11. С. 687–691.
Для цитирования: Омаров Т.Р., Омарова Л.А. Грибковые поражения желудочно-кишечного тракта. РМЖ. 2016;11:687-691.
Fungal infections of gastrointestinal tract
Omarov T.R. 1 ,Omarova L.A. 2
1 Republican Scientific Center of Emergency Medical Aid, Astana, Kazakhstan
2 Medical University Astana, Kazakhstan
According to the World Health Organization, about 20% of the world’s population are affected by mycoses. Currently, the mankind experiences an outbreak of opportunistic infections, and mycoses are among the leading causes. In recent years, candida is the most common etiological agent of opportunistic mycoses. Beginning from the antibiotic era and until the present day, the morbidity associated with candidiasis has significantly increased and continues to grow. Adverse environmental conditions which affect immune system have an important role in candidiasis as well. Candidiasis generally occurs endogenously as a result of immune dysfunctions and metabolic disorders. Candidiasis can be systemic and disseminated due to massive growth spurt thus transforming into fungal sepsis which affects kidneys, heart, spleen, and brain, or even into septic shock.
The paper discusses pathogenic aspects of human fungal infections, resistance, host immune responses, mixed infections, and dysbiosis. Epidemiology, clinical signs, and diagnosis of gastrointestinal mycoses with various localization (oral/oropharyngeal, gastric, enteric) are described in details.
Key words: mycosis, сandidiasis, mixed infection, dysbiosis, immune deficiency, AIDS
For citation: Omarov T.R., Omarova L.A. Fungal infections of gastrointestinal tract // RMJ. Gastroenterology. 2016. № 11. P. 687–691.
Статья посвящена вопросам грибковых поражений желудочно-кишечного тракта
Сегодня человечество переживает эпидемию оппортунистических инфекций, среди которых микозам принадлежит одно из ведущих мест. По данным ВОЗ, в последнее десятилетие около 20% населения мира страдает микозами [1].
Микозы – инфекционные заболевания, этиологическим возбудителем которых являются грибы. Чаще всего микозом болеют люди, имеющие первичные или вторичные иммунодефицитные состояния [2]. Микоз относится к оппортунистическим инфекциям [3, 4].
Грибы – низшие растения (более 100 тыс. видов), лишенные хлорофилла, поэтому для их существования требуются готовые органические вещества. Подавляющее большинство грибов относится к сапрофитам, меньшая часть из них – паразиты человека и животных. Около 500 видов грибов могут вызывать инфекционные болезни у человека. Чаще всего у человека встречаются дрожжеподобные С. albicans [5]. Кандидоз – антропонозный микоз, характеризующийся поражением слизистых оболочек и кожи.
Поражения у человека вызывают С. albicans (более 90% поражений), С. tropicalis, С. krusei, С. lusitaniae, С. parapsilosis, С. kefyr, С. guilliermondii и др. [6–8]. В начале XX в. кандидозы наблюдали сравнительно редко. С началом применения антибиотиков и по настоящее время заболеваемость кандидозами значительно возросла и продолжает расти. Немаловажное значение в развитии кандидозов имеет неблагоприятная экологическая обстановка, оказывающая отрицательное воздействие на иммунную систему организма человека [9]. Кандидоз обычно возникает эндогенно в результате дисфункций иммунной системы и дисметаболических расстройств в организме. В последние годы кандиды являются наиболее распространенными возбудителями оппортунистических микозов [4]. При поражении организма кандидами возможно развитие тяжелых висцеральных форм, чаще с вовлечением легких и органов пищеварения и других систем организма. Кандидоз может носить системный характер и стать диссеминированным (массивный рост возбудителя в организме) и принять картину грибкового сепсиса с поражением всех органов (почек, сердца, селезенки, мозга), а иногда с развитием септического шока [10]. Чаще эта форма кандидоза поражает больных с последней стадией рака и СПИДа [11, 12].
Лечение направлено на быстрое устранение признаков инфекции и восстановление нормального неврологического статуса. Проводится вплоть до нормализации всех показателей спинномозговой жидкости и рентгенологических данных при стабилизации неврологических функций.
Препараты выбора ? амфотерицин или флуконазол внутривенно. К амфотерицину может быть добавлен флуцитозин. Благодаря способности проникать через гематоэнцефалический барьер, его часто присоединяют к амфотерицину.
Может использоваться как обычный, так и липосомальный амфотерицин.
Для начальной терапии применяется комбинация обычного амфотерицина (0,7-1,0 мг/кг/сут) и флуцитозина (25 мг/кг/сут). Доза флуцитозина подбирается отдельно и должна обеспечить достижение сывороточных концентраций 40-60 мкг/мл.
Что касается использования флуконазола при менингите, имеются данные только о его использовании после амфотерицина и флуцитозина или в целях длительной супрессивной терапии.
В связи с тенденцией к рецидивам терапия проводится не менее 4 недель после исчезновения признаков инфекционного процесса.
Терапия кандидозного менингита, связанного с нейрохирургическими процедурами, включает удаление всех инородных материалов и устройств.
Кандидозный эндофтальмит
Лечение преследует ликвидацию опасных для органа зрения повреждений.
Препарат первого выбора – амфотерицин для внутривенных иньекций. Имеются данные об эффективности флуконазола при пероральном и внутривенном использовании.
Флуцитозин обычно используется в комбинации с амфотерицином. Использование липидного комплекса амфотерицина в дозе 4,5 мг/кг/сут на протяжении 6 недель в сочетании с витрэктомией может способствовать сохранению зрения.
Целесообразность введения антимикотиков в стекловидное тело до конца не установлена. На сей счет имеются отдельные публикации в отношении обычного амфотерицина и его комбинации с флуцитозином и флуконазолом.
Всем пациентам с кандидемией рекомендуется по крайней мере одно офтальмологическое обследование.
Наибольший опыт накоплен в использовании амфотерицина, как изолированно, так и в комбинации с флуцитозином.
Флуконазол рекомендуется для последующей терапии.
С целью достижения оптимальных концентраций амфотерицина в глазном яблоке его рекомендуют вводить в максимальных дозах.
Лечение проводится до полного исчезновения признаков заболевания или стабилизации состояния пациента. Егопродолжительность составляет 6-12 недель.
При эндофтальмите неизвестной этиологии проводится диагностическая пункция стекловидного тела.
При обнаружении грибковых элементов назначаются инсталляции амфотерицина.
Польза витрэктомии в больших клинических испытаниях не изучалась, но может использоваться у пациентов со значительной потерей зрения.
Кандидозные эндо-, пери- и миокардиты, гнойный флебит
При эндо-, пери-, миокардите и гнойном флебите хирургическое вмешательство сочетают с противогрибковой терапией.
Препаратами выбора считаются амфотерицин для внутривенного введения, флуконазол внутрь или внутривенно. К амфотерицину может также добавляться флуцитозин.
При гнойном флебите с вовлечением в процесс центральных вен проводится терапия амфотерицином для внутривенного введения.
При гнойном тромбофлебите периферических вен они подвергаются хирурической резекции, а противогрибковая терапия проводится амфотерицином или флуконазолом.
Целесообразность назначения антикоагулянтов не доказана.
Кандидозный миокардит обычно является одним из проявлений диссеминированного кандидоза, клинически не выражен и лечится как его составная часть.
Кандидозные эндо-, пери-, миокардит и гнойный флебит связаны с высоким риском заболеваемости и смертности и требуют своевременных активных хирургических и терапевтических вмешательств.
При поражении клапанов сердца они удаляются. Амфотерицин назначается в максимально переносимых дозах в комбинации или без флуцитозина с общей продолжительностью лечения не менее 6 недель после хирургического вмешательства.
Кандидозный эндокардит часто рецидивирует и требует тщательного наблюдения за пациентом не менее 1 года после операции.
Если удаление клапана невозможно, проводится длительная, часто пожизненная супрессивная терапия флуконазолом.
Имеется положительный опыт использования в качестве препаратов первого ряда флуконазола и липосомального амфотерицина.
Кандидозный перикардит требует хирургической санации полости перикарда и/или резекции в зависимости от распространенности процесса с последующей длительной терапией амфотерицином или флукопазолом.
При гнойном кандидозном тромбофлебите периферических вен осуществляется хирургическая резекция пораженных участков с последующим назначением антимикотиков на протяжении 2 недель. Подход не отличается от описанного для острого гематогенного диссеминированного кандидоза.
Кандидоз нижних дыхательных путей
Известны две формы кандидозной пневмонии: первичная (после аспирации орофарингеального содержимого у пациентов с тяжелым иммунодефицитом) и вторичная (при гематогенной диссеминации).
Диагноз кандидозной пневмонии удается поставить только путем гистологического исследования.
Кандидозная пневмония встречается крайне редко, главным образом среди пациентов с онкологическими заболеваниями, и ассоциируется с высоким уровнем летальности.
В большинстве случаев в лечении кандидозной пневмонии используется амфотерицин для внутривенного введения, но при менее тяжелых формах может использоваться и флуконазол.
Нерациональное использование антимикотиков у пациентов с трахеобронхиальной колонизацией или орофарингеальной контаминацией респираторного секрета может привести к селекции резистентных штаммов.
Считается, что у большинства пациентов с первичной кандидозной пневмонией и кандидозом гортани для лечения должен использоваться амфотерицин в дозе 0,7-1,0 мг/кг/сут.
При вторичной пневмонии, возникающей при гематогенном диссеминировании, лечение проводится как при гематогенно диссеминированном кандидозе.
Кандидоз желчного пузыря, поджелудочной железы и брюшины
Целью лечения является не только эрадикация инфекции, но и предотвращение рецидивов.
Используется амфотерицин для внутривенного введения, а также флуконазол внутрь или внутривенно. При кандидозе вследствие использования катетеров для перитонеального диализа они подлежат удалению.
Кандидозный перитонит своей причиной может иметь хирургическое или травматическое повреждение стенки кишечника.
К группе риска относят также пациентов после проведенного курса химиотерапии по поводу опухолей либо иммуносупрессивной терапии после трансплантации и при системных заболеваниях соединительной ткани.
Обращается внимание на нецелесообразность рутинной противогрибковой терапии после полного заживления повреждения/перфорации внутренних органов у относительно здоровых пациентов без признаков септического состояния.
Во всех случаях поражения желчных путей требуется восстановление пассажа желчи в сочетании с терапией амфотерицином или флуконазолом, которые накапливаются в желчи. Локальные инсталляции препаратов не требуются.
При катетер-ассоциированном перитоните катетер следует удалить и провести системную противогрибковую терапию амфотерицином или флуконазолом. Новый катетер разрешается устанавливать спустя 2 недели.
НЕ рекомендуется интраперитонеальное введение амфотерицина, которое сопровождается выраженным болевым синдромом с химическим перитонитом.
Кандидозный перитонит из-за попадания каловых масс в брюшную полость требует хирургического вмешательства, дренажа и назначения амфотерицина или флуконазола.
При перитоните продолжительность лечения основывается на скорости ответа пациента на него и требует от 2 до 3 недель.
Пациенты с рецидивирующей перфорацией кишечника находятся в группе высокого риска развития кандидозного перитонита, который можно избежать профилактическим назначением антимикотиков.
Кандидоз мочевыводящих путей
Наиболее часто развивается при инструментальных вмешательствах на мочевыводящих путях, предшествовавшем приеме антибактериальных препаратов и у лиц пожилого возраста.
У большинства пациентов выделение грибов рода Candida свидетельствует только о колонизации.
Целью лечения кандидоза мочевыводящих путей является эрадикация грибов с исчезновением клинических признаков заболевания.
У части пациентов лечение позволяет снизить риск восходящей инфекции или ее диссеминацию.
При кандидемии удаление мочевого катетера приводит к ликвидации кандидурии не более чем у 40% пациентов.
В лечении препаратами выбора являются флуконазол внутрь или внутривенно, амфотерицин внутривенно или флуцитозин внутрь.
При ирригациях с амфотерицином лечение не эффективно, если поражение локализуется выше уровня мочевого пузыря.
Имеются данные, что при кандидурии флуконазол в дозе 200 мг в сутки в течение 14 дней ускоряет время эрадикации возбудителя из мочи.
У некоторых групп пациентов, например, с обструктивной уропатией, кандидурия может быть источником диссеминированного процесса, особенно в случаях с нейтропенией, текущими или планирующимися инструментальными вмешательствами на мочевыводящих путях, а также у новорожденных с низкой массой тела при рождении.
Асимптоматическая кандидурия редко требует лечения, но может быть единственным свидетельством диссеминированного кандидоза.
Лечение показано только пациентам с признаками инфекции, нейтропенией, новорожденным с низкой массой тела при рождении, после пересадки почки и при планировании инструментального вмешательства на мочевыводящих путях.
Короткие курсы противогрибкового лечения не рекомендуются, оно должно составлять от 7 до 14 дней.
Удаление стентов и катетеров Фолея позволяет быстрее достичь положительного эффекта лечения.
Возможно использование флуконазола в дозе 200 мг/сут в течение 7-14 суток и амфотерицина в дозе 0,3-1,0 мг/кг/сутки в течение 1-7 дней.
Вне почечной недостаточности флуцитозин в дозе 25 мг/кг/сут может быть альтернативой для эрадикации не-albicans штаммов грибов рода Candida. Однако при его использовании в режиме монотерапии существует высокая вероятность быстрого развития резистентности возбудителя.
Ирригации мочевого пузыря амфотерицином в дозе 50-200 мг/мл могут приостановить кандидурию, но показаны редко, если не считать использования в составе диагностических процедур.
Частота рецидивов велика при продолжающемся использовании мочевого катетера.
Персистирующая кандидурия у иммунокомпрометированных пациентов требует проведения ультразвукового исследования или компьютерной томографии почек.
Кандидозный остеомиелит, артрит и медиастинит
Тяжелые исходы кандидозного остеомиелита и артрита с деформацией суставов и утратой трудоспособности вне лечения дают основания для агрессивной хирургической тактики и противогрибковой терапии.
Клинически кандидозный медиастинит может протекать со скудной симптоматикой и возникает достаточно поздно. Хирургическая санация, биопсия и дренирование позволяют поставить более точный диагноз до начала продолжительной терапии, которая требуется в этом случае.
При остеомиелите следует сочетать хирургическую санацию пораженных тканей с противогрибковой терапией. Препаратом выбора может быть амфотерицин в дозе 0,5-1,0 мг/кг/сут на протяжении 6-10 недель или флуконазол.
Введение обычного амфотерицина в костный матрикс безопасно и аффективно при осложненных формах остемиелита, поэтому наиболее рациональной является хирургическая санация с назначением антимикотика. Амфотерицин назначается на курс длительностью 2-3 недели с последующим переходом на флуконазол и общей продолжительностью лечения от 6 до 12 месяцев.
При кандидозном артрите требуется адекватный дренаж с внутривенным использованием амфотерицина и флуконазола. Имеются данные об эффективности изолированного применения флуконазола.
Так как парентеральное назначение амфотерицина и флуконазола создает достаточные концентрации их в синовиальной жидкости, необходимость внутрисуставного введения вызывает сомнения. Лечение должно быть длительным как при остеомиелите.
Кандидозный артрит с вовлечением искусственного сустава требует артропластики. После ликвидации очага инфекции и очищения полости сустава может быть поставлен новый протез.
При кандидозном медиастините проводится хирургическое вмешательство с последующим назначением амфотерицина или флуконазола.
Ирригация средостения амфотерицином не рекомендуется из-за опасности развития химического медиастинита. Также требуются длительные курсы терапии как при остеомиелите.
По следам рекомендаций Американского общества инфекционных болезней по лечению кандидоза 2004 г. с учетом изменений 2008 г.
Читайте также:


